Резюме
Цель: анализ тактики и результатов длительной ИВЛ у пациентов нейрохирургического профиля.
Материалы и методы: Исследование носило ретроспективный характер. Критерием включения являлась длительность ИВЛ более 48 часов. Были проанализированы 184 истории болезни пациентов нейрореанимационного отделения. Подбор режимов вентиляции, уходы за верхними дыхательными путями, протезирование верхних дыхательных путей осуществлялись по принятому в институте протоколу.
Результаты: Были выявлены значительные различия в структуре показаний к ИВЛ и в длительности респираторной поддержки в зависимости от нейрохирургической нозологии и локализации основного процесса. Было показано, что принятые в Институте протоколы ухода за верхними дыхательными путями позволяют снизить частоту развития вентилятор-ассоциированной пневмонии. Были выявлены некоторые факторы риска развития вентилятор-ассоциированной пневмонии.
Введение
Впервые ИВЛ была широко применена в Европе в 1952 при лечении пациентов с повреждением ЦНС во время эпидемии полиомиелита. Единственным способом спасения жизни пациентов с параличом дыхательной мускулатуры было замещение утраченной функции. Имя датского врача применившего ИВЛ для лечения пациентов с полиомиелитом первым Bjorn Ibsen (1915-2007) [10]. Для ИВЛ использовались ручные приспособления типа кузнечных мехов. В Дании в лечении этих пациентов участвовало 1500 студентов-медиков добровольцев. Первые аппараты ИВЛ называли «железный студент». В 1953 году Bjorn Ibsen возглавил первое в мире отделение интенсивной терапии. В Европе этого самоотверженного врача называют «отцом интенсивной терапии». За более чем полувековой период развития интенсивной терапии показания и области применения ИВЛ в лечении пациентов с поражением ЦНС существенно расширились. ИВЛ остаётся важнейшим, а зачастую и основным методом лечения пациентов отделений интенсивной терапии. С внедрением ИВЛ была положена основа создания специализированных отделений нейрореанимации в 60 – 70 годах ХХ века. В настоящей работе представлен годовой анализ использования продолжительной ИВЛ в лечении пациентов в отделении реанимации НИИ нейрохирургии им академика НН Бурденко, РАМН за 2009 год.
Материалы и методы
Исследование носило ретроспективный характер и было основано на анализе историй болезни пациентов, находившихся на лечении в отделении реанимации с января по декабрь 2009 г. Включительно. Критерием включения являлась продолжительность ИВЛ свыше 48 часов. Анализировалась длительность ИВЛ и показания к пролонгированной ИВЛ у разных категорий больных, сроки экстубации, сроки трахеостомии, частота развития вентилятор-ассоциированной пневмонии.Согласно критериям включения, для анализа было отобрано 184 истории болезни. Среди включенных в исследование пациентов было 95 мужчин и 89 женщин в возрасте от 2 месяцев до 89 лет (средний возраст составил 38,6±19,2 лет).
В таблице 1 представлено разделение пациентов, нуждавшихся в пролонгированной ИВЛ, по нозологии.
Таблица №1 Распределение пациентов по нозологии (N=184)
| N | % | |
| Нейроонкология | 110 | 59,8% |
| Черепно-мозговая травма | 33 | 17.9% |
| Разрыв артериальной аневризмы | 19 | 10,3% |
| Гипертонические внутричерепные кровоизлияния | 5 | 2,7% |
| ОНМК по ишемическому типу | 11 | 6% |
| Другие заболевания ЦНС | 6 | 3,3% |
Пациенты с опухолями головного мозга были условно разделены на 6 групп в зависимости от локализации патологического процесса (Таблица 2).
Таблица №2 Распределение пациентов с нейроонкологией по локализации процесса (N=110)
| N | % | |
| Полушарная локализация | 34 | 30,9% |
| Задняя черепная ямка | 39 | 35,5% |
| Основание черепа | 13 | 11,8% |
| Хиазмально-селлярная область | 14 | 12,7% |
| Пинеальная область | 6 | 5,5% |
| Краниоспинальный переход | 4 | 3,6% |
Пациенты с нетравматическими субарахноидальным кровоизлияниями вследствие разрыва артериальных аневризм сосудов головного мозга были разделены на 4 подгруппы в зависимости от локализации аневризмы (Таблица 3).
Таблица №3 Распределение пациентов с нетравматическими субарахноидальными кровоизлияниями по локализации аневризмы (n=19)
| n | % | |
| Средняя мозговая артерия | 8 | 42,1 |
| Передняя соединительная – передняя мозговая артерия | 5 | 26,3 |
| Внутренняя сонная артерия | 4 | 21,1 |
| Вертебро-базиллярная система | 2 | 10,5 |
Методы протекции дыхательных путей
Из 184 пациентов, нуждавшихся в продленной ИВЛ, 9 (4,9%) были трахеостомированы и респираторная поддержка проводилась через трахеостомическую трубку. У остальных 175 (95,1%) пациентов для осуществления респираторной поддержки была произведена оротрахеальная интубация.Показаниями для выполнения трахеостомии были: 1. Ожидаемая длительная ИВЛ (>7 cуток); 2. Грубые нарушения глотания [3]; 3. Удаление опухоли трансоральным доступом. Всем взрослым пациентам пункционно-дилятационная трахеостомия (ПДТ) выполнялась по модификации, разработанной в Институте [1,2,4]. Во всех сложных случаях (короткая, толстая шея, положение без валика под плечами или иное нарушение анатомических ориентиров) на этапе пункции трахеи выполняется фиброскопический контроль.
Методика ухода за дыхательными путями
Уход за трахеостомой.
Кожа вокруг трахеостомы обрабатывалась раствором «Октенисепт», затем на область вокруг стомы накладывалась мазь «Бетадин» на основе повидон-йода и стерильные салфетки. Перевязки выполнялись 2 раза в сутки, а в случае пропитывания салфеток отделяемым из стомы, - чаще. Использовался условный критерий «вокруг трахеостомы всегда чистая, сухая салфетка». Санация носовых ходов выполнялась минимум 3-4 раза в сутки с использованием тонкого мягкого санационного катетера. После санации в носовые ходы впрыскивалась аэрозоль «Биопарокс». При обильном отделении слизи из носовых ходов, аспирация слизи производилась чаще, дополнительно использовались препараты на основе ксилометазолина («Нафтизин», «Галазолин»). В 9 случаях, при выявлении синуситов выполнялись лечебные пункции гайморовых пазух с отмыванием содержимого раствором «мирамистин» и последующим введением антибиотиков.
Санация ротоглотки.
Полость рта и зубы обрабатывались с использованием раствора и аэрозоли «Гексорал» два раза в сутки или чаще. Для механического удаления густой слизи и налётов использовались палочки с ватными тампонами на конце. Часть трахеостомированных пациентов на ИВЛ получала пероральное кормление. В этом случае рот обрабатывали после каждого кормления, начиная с полоскания рта чистой водой. Для ротоглотки использовались гибкие мягкие санационные катетеры и твердые пластиковые изогнутой формы.
Санация трахеи
выполнялась с использованием гибких одноразовых стерильных катетеров. После однократного использования катетер выбрасывался. При наличии избыточного количества мокроты гнойного характера при санации использовался 0,1% раствор диоксидина, ex-temporo приготовленный на физиологическом растворе. При санационных фибробронхоскопиях использовался такой же раствор.У всех трахеостомированных пациентов были использованы трахеостомические трубки с каналом для санации надманжеточного пространства и особо мягкой герметизирующей манжетой, – трубки фирмы «Portex» серии «Blue line Ultra Soft Seal». Использование таких трубок позволяло эффективно удалять из трахеи секрет, скапливающийся выше герметизирующей манжеты и промывать верхние отделы трахеи и гортань.
Методика проведения ИВЛ
Искусственная вентиляция легких проводилась с использованием аппаратов Puritan Bennet 7200. Стартовым режимом ИВЛ во всех случаях был режим SIMV. Дыхательный объем составлял 8-10мл/кг. Исходная частота дыханий составляла 10-12. Поддержка давлением составляла 12-16 мбар. При появлении самостоятельных дыхательных попыток частота дыхания аппаратных вдохов уменьшалась, а уровень поддержки давлением подбирался с целью обеспечения нормовентиляции (минутный объем 100 мл/кг/мин, РаCO2 35-40 мм.рт.ст.). При развитии бради- или тахипноэ наращивалась частота принудительных вдохов. Специфика подбора параметров вентиляции у пациентов с ЧМТ и с дисфункцией ствола описана ниже.Отлучение пациентов от респиратора проводилось либо путем постепенного уменьшения числа принудительных вдохов в режиме SIMV, либо путем перевода в режим Pressure Support с постепенным снижением уровня поддержки давлением.
Методика увлажнения дыхательных путей
У всех пациентов, находившихся на ИВЛ более суток, для увлажнения дыхательной смеси использовались увлажнители – обогреватели Fisher&Pyker, где в дополнение к емкости испарителя в шлангах проложен нагревающий провод. Благодаря системе автоматического поддержания температуры, получающей информацию из трех точек дыхательного контура, удаётся добиться оптимального увлажнения и согревания дыхательной смеси и избежать выпадения конденсата в дыхательном контуре. Для оценки качества увлажнения использовалась шкалу оценки вязкости бронхиального секрета [9]. 1. Жидкий – после аспирации мокроты санационный катетер чист. 2. Умеренно вязкий – после аспирации мокроты санационный катетер сразу очищается при промывании водой. 3. Вязкий – после аспирации мокроты санационный катетер трудно отмыть от мокроты. Во всех наблюдениях консистенция мокроты у пациентов на ИВЛ была жидкой.При анализе данных использовались методы описательной статистики. Данные представлены, как среднее ± стандартное отклонение.
Результаты и обсуждение
Анализ особенностей ИВЛ при различных нозологиях
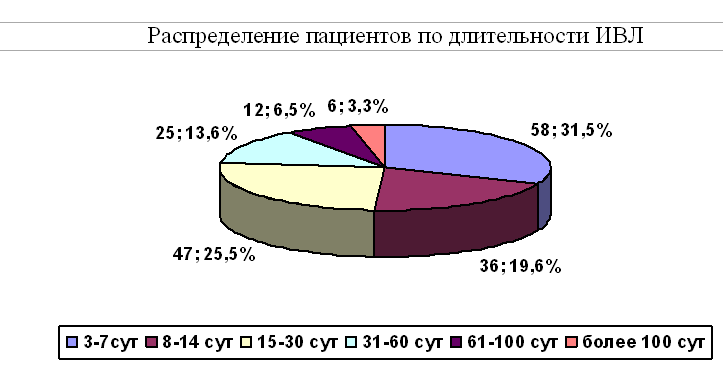
Средняя длительность ИВЛ составила 28,7±32,7 (от 3 до 328 суток). Распределение пациентов по длительности ИВЛ представлено на рисунке 1.При анализе зависимости длительности ИВЛ от нозологии было показано, что длительность ИВЛ была значительно ниже у пациентов с гипертоническими внутричерепными кровоизлияниями по сравнению с другими группами. Длительность ИВЛ у пациентов с остальными нозологиями статистически значимо не различались.Наиболее частой причиной проведения продленной ИВЛ являлось угнетение сознания - 101 пациент (54,9%), на втором месте была дисфункция ствола 52 (28,3%) пациентов, из которых у 22 (12%) на первый план выходило угнетение респираторного драйва, а у 30 (16,3%) грубые бульбарные нарушения, требующие длительного протезирования дыхательных путей. У 27 (14,7%) пациентов причиной пролонгирования ИВЛ была необходимость седации в связи с судорожным синдромом (13 больных) или психо-моторным возбуждением (14 больных). Дыхательная недостаточность связанная с заболеванием легких была причиной ИВЛ всего у 4 (2,2%) больных. Распределение больных по причине пролонгирования искусственной вентиляции легких с учетом нозологии представлено в таблице 4.
Таблица №4 Длительность ИВЛ у пациентов с различной нозологией (сут)
| Нейроонкология (n=110) | 26,6±23 |
| Черепно-мозговая травма (n=33) | 21,4±24 |
| Разрыв артериальной аневризмы (n=19) | 26,8±43 |
| Гипертонические внутричерепные кровоизлияния (n=5) | 16,5±14,0 |
| ОНМК по ишемическому типу (n=5) | 39,0±49,4 |
Распределение пациентов по длительности ИВЛ
ИВЛ при черепно-мозговой травме
Средняя длительность ИВЛ у пациентов с ЧМТ составила 21,4±24 суток. В группе пациентов с ЧМТ наиболее частой причиной проведения ИВЛ было угнетение сознания (29 из 33 пациентов, 87,9%) (Таблица 5).
Таблица №5 Распределение пациентов с различной нозологией по причине пролонгирования ИВЛ
| ЧМТ (n=33) | Нейроонкология (n=110) | Разрыв артериальной аневризмы (n=19) | Гипертоническое внутричерепное кровоизлияиние (n=5) | Ишемический инсульт (n=11) | Прочее (n=6) | Всего (n=184) | |
| Угнетение сознания | 29 (87,9%) | 48 (43,6%) | 12 (63,2%) | 4 (80%) | 7 (63,6%) | 1(16,7%) | 101 (54,9%) |
| Дисфункция ствола | 0 (0%) | 39 (35,5%) | 4 (21,1%) | 1 (20%) | 4 (36,4%) | 4 (66,7%) | 52 (28,3%) |
| Угнетение респираторного драйва | 0(0%) | 15 (13,6%) | 1(5,3%) | 1(20%) | 2 (18,2%) | 3(50%) | 22(12,0%) |
| Бульбарные нарушения | 0(0%) | 24 (21,8%) | 3 (15,8%) | 0(0%) | 2 (18,2%) | 1(16,7%) | 30(16,3%) |
| Необходимость седации | 4 (12,1%) | 19 (17,3%) | 3 (15,8%) | 0 (0%) | 0 (0%) | 1(16,7%) | 27(14,7%) |
| В связи с судорожным синдромом | 2 (6,1%) | 7 (6,4%) | 3 (15,8%) | 0(0%) | 0(0%) | 1(16,7%) | 13(7,1%) |
| В связи с психо-моторным возбуждением | 2(6,1 %) | 12 (10,9) | 0(0%) | 0(0%) | 0(0%) | 0(0%) | 14(7,6%) |
| Паренхиматозная дыхательная недостаточность | 0 (0%) | 4 (3,6%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 4(2,2%) |
ИВЛ при ЧМТ проводилась при уровне сознания 9 баллов по ШКГ и ниже. Обязательными компонентами мультимодального мониторинга у пациентов с ЧМТ, находящихся в коматозном состоянии, являлись мониторинг внутричерепного давления и капнография.Минутный объем вентиляции подбирался с целью достижения умеренной гипервентиляции (EtCO2 32-35 mmHg). В ряде случаев (14 пациентов), при устойчивой внутричерепной гипертензии минутный объем вентиляции увеличивался до достижения глубокой гипервентиляции (EtCO2=28-30 mmHg). В этих случаях во избежание ишемии вследствие гипокапнической вазоконстрикции в обязательном порядке проводился мониторинг церебральной оксигенации и/или церебрального кровотока. У 12 больных мониторинг церебральной оксигенации проводился методом непрерывного мониторинга насыщения гемоглобина кислородом в яремной вене (SjvO2) посредством ретроградной катетеризации яремной вены фиброоптическим оксиметрическим катетером Abbott Opticath (Abbott Laboratories, Chicago, IL). Критерием безопасности проводимой гипервентиляции мы считали значение SjvO2 55% и выше [5]. У 5 больных проводился мониторинг регионарного церебрального кровотока методом термодиффузии с использованием монитора Hemedex (Hemedex, USA). Критерием безопасности проводимой гипервентиляции мы считали регионарный кровоток выше 18мл/100мг/мин [7].Фракция кислорода во вдыхаемой смеси подбиралась под контролем газового состава артериальной крови для поддержания PaO2 90-100 мм рт.ст. Средняя FiO2 в остром периоде ЧМТ составляла 34,8±6,5 %.Следует отметить, что частота развития вентилятор-ассоциированной пневмонии у пациентов с ЧМТ была значительно выше, чем у пациентов с другими нозологиями и составила 72,7% (24 из 33 пациентов), что, по всей видимости, обусловлено высоким риском аспирации на догоспитальном этапе.
ИВЛ при нейроонкологии
Средняя длительность ИВЛ у пациентов с нейроонкологией составила 28,7±32,7 суток. Длительность ИВЛ была наибольшей у пациентов с локализацией процесса в области краниоспинального перехода и наименьшей у пациентов с опухолями основания черепа и пинеальной области (рисунок 2).
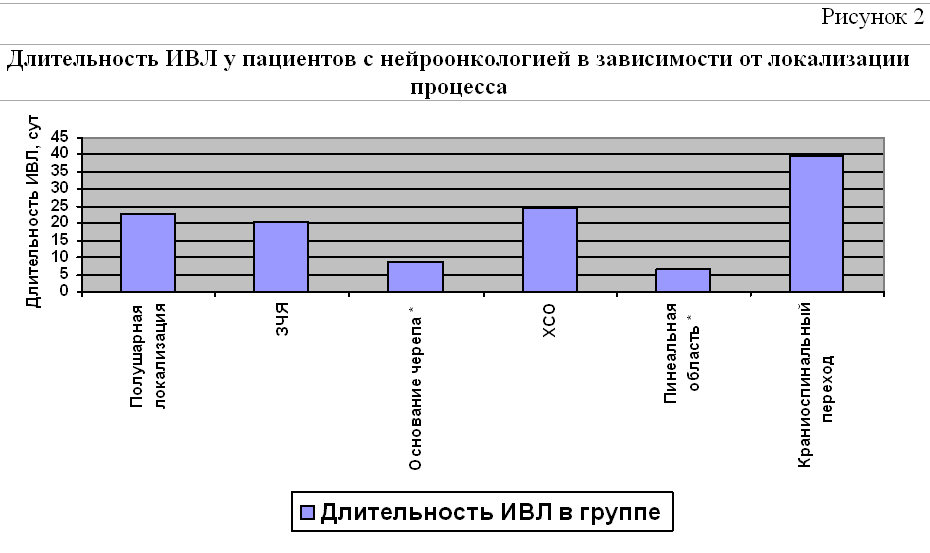 Также были выявлены различия в структуре показаний к продлению ИВЛ при разной локализации процесса (Таблица 6).
Также были выявлены различия в структуре показаний к продлению ИВЛ при разной локализации процесса (Таблица 6).
Таблица №6 Распределение пациентов с нейроонкологией по причине пролонгирования ИВЛ с учетом локализации процесса
| Полушария (n=34) | ЗЧЯ (n=39) | Основание (n=13) | ХСО (n=14) | Пинеальная область (n=6) | Краниоцеребральный переход (n=4) | |
| Угнетение сознания | 24 (70,6%) | 9 (23,1%) | 8 (61,5%) | 5 (35,7%) | 2 (33,3%) | 0 (0%) |
| Дисфункция ствола | 3 (8,8%) | 29 (74,3%) | 2 (15,4%) | 2 (14,3%) | 2 (33,3%) | 1 (25,0%) |
| Угнетение респираторного драйва | 3 (8,*%) | 10 (25,6%) | 2 (15,4%) | 0(0%) | 0(0%) | 0(0%) |
| Бульбарные нарушения | 0(0%) | 19(48,7%) | 0(0%) | 2 (14,3%%) | 2 (33,3%) | 1 (25%) |
| Необходимость седации | 7 (20,6%) | 0 (0%) | 3 (23,0%) | 7 (50,0%) | 2 (33,3%) | 0 (0%) |
| В связи с судорожным синдромом | 5(71,4%) | 0(0%) | 2 (66,7%) | 0(0%) | 0(0%) | 0(0%) |
| В связи с психо-моторным возбуждением | 2 (28,6%) | 0(0%) | 1 (33,3%) | 7 (100%) | 2 (100%) | 0(0%) |
| Паренхиматозная дыхательная недостаточность | 0 (0%) | 1 (2,6%) | 0 (0%) | 0 (0%) | 0 (0%) | 3 (75,0%) |
Среди пациентов с локализацией процесса в полушариях и на основании головного мозга основным показанием к продленной ИВЛ было угнетение сознания. Среди пациентов, оперированных на задней черепной ямке, основным показанием к пролонгированию ИВЛ служила стволовая дисфункция (29 из 39 больных) либо в виде угнетения респираторного драйва (10 из 39 больных, 34,5%), либо в виде бульбарных нарушений (19 из 49 больных, 65,5%).Хотя бульбарные нарушения не являются показанием к искусственной вентиляции легких, а требует исключительно защиты дыхательных путей путем их протезирования, в ряде случаев наличие грубого бульбарного синдрома служило причиной пролонгированной ИВЛ. Так у 19 пациентов, оперированных по поводу опухолей задней черепной ямки, у которых в раннем послеоперационном периоде было восстановлено ясное сознание, прошедших тест спонтанного дыхания (Spontaneous breathing trial), искусственная вентиляция легких была пролонгирована в связи с грубыми нарушениями глотания. Средняя длительность ИВЛ у этой подгруппы пациентов составила 4,2±1,7 суток. Из 19 пациентов с бульбарным синдромом 9 пациентов были успешно экстубированы на 3-5 день после операции. У 10 пациентов попытка экстубации оказалась неуспешной и для защиты дыхательных путей от аспирации была выполнена трахеостомия, после чего ИВЛ была прекращена.
Поражение стволовых структур может сопровождаться различными вариантами дыхательной недостаточности центрального генеза. Поражение верхних мотонейронов дыхательной группы, расположенных в вентральной и дорсальной группах медуллярных нейронов, приводит к резкому снижению силы дыхательных попыток при сохраненном ритме дыхания. Клинически это проявляется поверхностным дыханием с нормальной или повышенной частотой, приводящим к клинической картине вентиляционной дыхательной недостаточности. Среди пациентов, оперированных по поводу околостволовых опухолей, развитие поверхностного дыхания с нормальной или повышенной частотой было отмечено у 6 пациентов. Средняя длительность ИВЛ в этой подгруппе больных составила 28,6±12,1 суток. При этом большую часть времени (20,2±8,4 суток) ИВЛ осуществлялась в режиме Pressure Support Ventilation.
При поражении бульбоспинального тракта развивается поверхностное дыхание со сниженной частотой, вплоть до апноэ. Такой вариант нарушения центральной регуляции дыхании нами был отмечен в 4 случаях. Средняя длительность ИВЛ в этой подгруппе больных составила 32,4±18,7 суток, из которых 25,6±10,5 суток ИВЛ осуществлялась в режиме SIMV с частотой принудительных вдохов 8-10 в мин.
У пациентов с опухолями ХСО и осложненным течением послеоперационного периода чаще, чем в других группах развивается психомоторное возбуждение, спутанность, дезориентация в месте, времени, личной ситуации, а также агрессия по отношению к самим себе и медицинскому персоналу. Это требует седации, которая может вызывать гипоксемию и вторичное повреждение головного мозга. Поэтому такие пациенты обычно нуждаются в продлении ИВЛ. Необходимость седации в связи с психомоторным возбуждением являлась наиболее частой причиной проведения пролонгированной ИВЛ (7 пациентов, 50%) у пациентов с опухолями ХСО и осложненным послеоперационным периодом. Несколько реже пролонгирование ИВЛ было обусловлено угнетением сознания. Угнетение уровня сознания до комы являлось абсолютным показанием к проведению ИВЛ. Коматозное состояние отмечалось у 3 пациентов (42,9%) с осложненным течением послеоперационного периода. При угнетении сознания до сомноленции – сопора у пациентов с патологией ХСО часто развивается изменение респираторного драйва по типу частого поверхностного или редкого поверхностного дыхания. Это приводит к развитию гипоксемии, гипервентиляции или гиперкапнии, которые, в свою очередь, могут являться факторами вторичного повреждения мозга. Угнетение уровня сознания до сомноленции, сопровождающееся изменением респираторного драйва, наблюдалось у 2 пациентов (28,6%) с осложненным течением послеоперационного периода. Таким образом, угнетение сознания послужило причиной продленной ИВЛ в общей сложности у 5 пациентов (71,4%). Обращает на себя внимание то, что у 2 из 14 пациентов (28,6%) отмечалось нарушение глотания. Поэтому, несмотря на хиазмально-селлярную локализацию опухоли, следует помнить, что у этих пациентов нарушения глотания могут развиваться как по бульбарному, так и по псевдобульбарному типу.
ИВЛ при нетравматических субарахноидальных кровоизлияниях
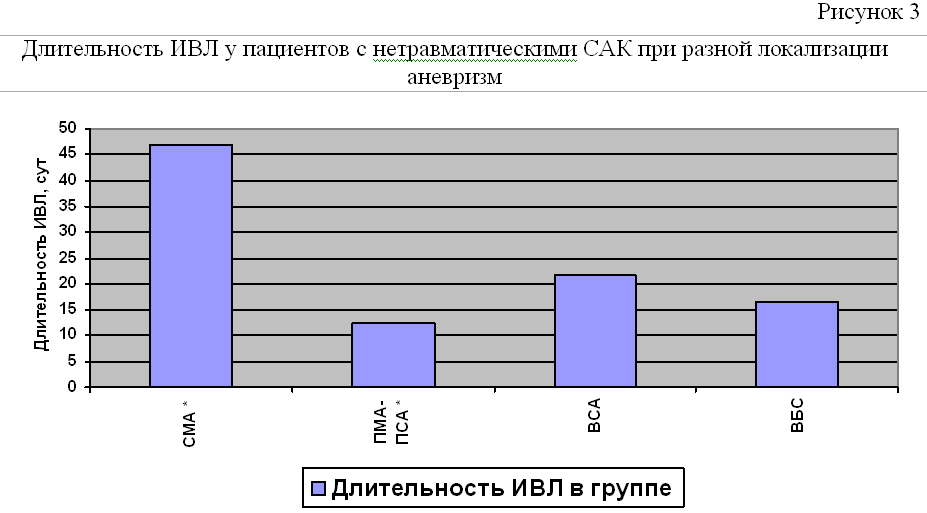
Средняя длительность ИВЛ у пациентов с нетравматическими САК вследствие разрыва артериальных аневризм сосудов головного мозга составила 26,8±43 суток. При этом наибольшая длительность ИВЛ была при разрывах артериальных аневризм СМА, а наименьшая при разрывах артериальных аневризм ПМА-ПСА (Рисунок №3).
При разрывах аневризм СМА и ВСА наиболее частой причиной пролонгирования ИВЛ служило угнетение сознания. При разрывах ПМА-ПСА более частой причиной пролонгирования ИВЛ служила необходимость седации в связи с психо-моторным возбуждением. Из двух больных с аневризмами в бассейне вертебробазилярной системы у одной больной продленная ИВЛ была обусловлена угнетением уровня сознания до комы, а у одного больного стволовой дисфункцией, проявляющейся, в том числе, угнетением респираторного драйва (таблица 7).
Таблица 7 Распределение пациентов с сосудистой патологией по причинам ИВЛ в зависимости от пораженного бассейна
| СМА (n=8) | ПМА-ПСА (n=5) | ВСА (n=4) | ВБС (n=2) | Всего (n=19) | |
| Угнетение сознания | 6 (75%) | 2 (40%) | 3 (75%) | 1(50%) | 12(63,2%) |
| Дисфункция ствола | 1 (12,5%) | 0(0%) | 1 (25%) | 1 (50%) | 3 (15,8%) |
| Угнетение респираторного драйва | 0(0%) | 0(0%) | 1(75%) | 1(0%) | 2(10,5%) |
| Бульбарные нарушения | 1(100%) | 0(0%) | 0(0%) | 0(0%) | 1(5,3%) |
| Необходимость седации | 1(12,5%) | 3(60%) | 0(0%) | 0(0%) | 4 (21,1%) |
| В связи с судорожным синдромом | 0(0%) | 0(0%) | 0(0%) | 0(0%) | 0(0%) |
| В связи с психо-моторным возбуждением | 1(12,5%) | 3(60%) | 0(0%) | 0(0%) | 4(21,1%) |
В таблице 8 представлена зависимость длительности ИВЛ от значений линейной скорости кровотока по СМА. Из таблицы видно, что развитие вазоспазма вследствие нетравматического САК сопровождалось значительным увеличением длительности респираторной поддержки.
Таблица 8 Зависимость длительности ИВЛ от линейной скорости кровотока по СМА у больных с САК
| ЛСК по СМА (максимальная за период наблюдения) | Длительность ИВЛ |
| 90-120 (n=3) | 14,2±12,4 |
| 130-200 (n=6) | 20,3±19,2 |
| Больше 200 (n=10) | 34,3±26,9 |
Увлажнение дыхательных путей
Анализ качества увлажнения дыхательных путей был выполнен на основании оценки данных фибробронхоскопии у 94 пациентов. Как указывалось в материалах и методах, у всех пациентов, находившихся на ИВЛ более суток, для увлажнения дыхательной смеси использовались увлажнители–обогреватели. В качестве группы сравнения мы использовали данные выполненной при поступлении бронхоскопии 15 пациентов, переведенных из других стационаров, где ИВЛ проводилась с использованием влагосберегающих фильтров. У всех 94 пациентов, у которых ИВЛ проводилась с использованием увлажнителей, консистенция мокроты была жидкой. Из 15 пациентов, переведенных из других стационаров после ИВЛ с использованием влагосберегающих фильтров, консистенция бронхиального секрета по шкале MacIntyre была жидкой только в 5 случаях (33,3%), умеренной вязкости в 7 (46,7%) случаях и вязкой в 3 (20%) случаях.
Вентилятор-ассоциированная пневмония (ВАП)
Диагноз вентилятор-ассоциированной пневмонии выставлялся при наличии инфильтративных изменений на рентгенограмме легких и наличии, как минимум, двух из четырех следующих критериев: температура тела больше 38,0ºС или меньше 36,0ºС; наличие гнойной мокроты; лейкоцитоз больше 11 тыс/мл или лейкопения менее 4 тыс/мл; PaO2/FiO2<300.Частота развития вентилятор-ассоциированной пневмонии составила 21,7% (40 из 184 пациентов). Достаточно низкую, по сравнению с литературными данными [6,8], частоту развития ВАП мы связываем, в первую очередь, с выполнением ранней трахеостомии, описанными выше особенностями ухода за дыхательными путями и использованием увлажнителей, а не влагосберегающих фильтров.У пациентов с ЧМТ частота развития ВАП была значительно выше, чем у пациентов после плановых нейрохирургических вмешательств (таблица 9).
Таблица 9 Частота развития вентилятор-ассоциированной пневмонии при различных нозологиях
| N | % | |
| Нейроонкология (n=110) | 16 | 14,5% |
| Черепно-мозговая травма (n=33) | 19 | 57,6% |
| Разрыв артериальной аневризмы (n=19) | 3 | 15,8% |
| Гипертонические внутричерепные кровоизлияния (n=5) | 1 | 20% |
| ОНМК по ишемическому типу (n=5) | 1 | 20% |
Более высокая частота развития ВАП у пациентов с ЧМТ, обусловлена, по видимому, высоким риском аспирации на догоспитальном этапе, неадекватным увлажнением вдыхаемой смеси при проведении ИВЛ по месту первичной госпитализации, высокой частотой синуситов (см. ниже).Другим фактором риска развития ВАП служила неуспешная попытка экстубации с последующей реинтубацией.Как было указано выше, из 184 пациентов, нуждавшихся в продленной ИВЛ, 9 (4,9%) были носителями трахеостомы и у них респираторная поддержка сразу проводилась через трахеостомическую трубку. У остальных 175 (95,1%) пациентов для осуществления респираторной поддержки была выполнена оротрахеальная интубация.
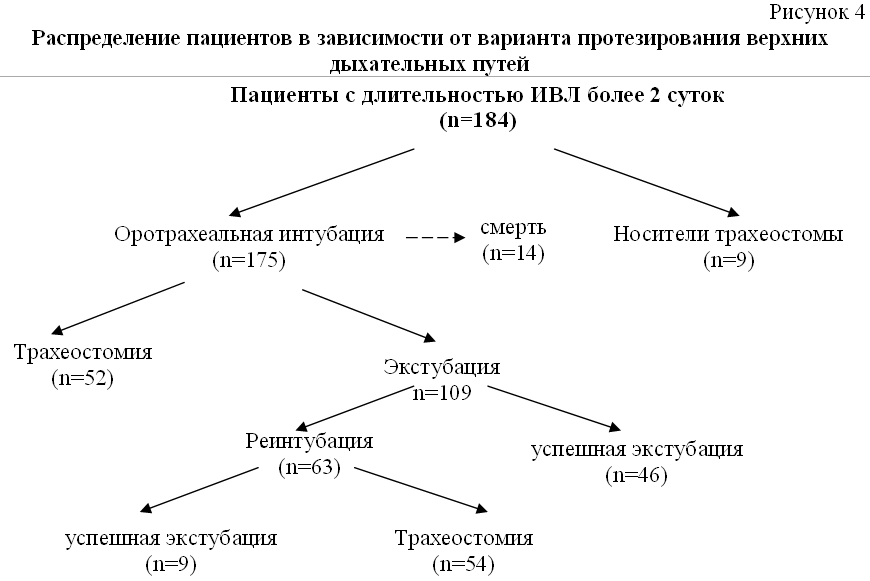
Из этих 175 пациентов 52 (29,7%) была выполнена ранняя трахеостомия, 109 (62,3%) пациентов были экстубированы. Экстубация и перевод на самостоятельное дыхание оказались успешными у 46 пациентов. Реинтубация и продолжение респираторной поддержки потребовалась у 63 пациентов, из них у 9 пациентов в последующем была выполнена успешная экстубация, а у 54 выполнена трахеостомия. Таким образом, общее число пациентов, которым была выполнена трахеостомия, составило 106 (57,6%) (Рисунок 4).
Распределение пациентов в зависимости от варианта протезирования верхних дыхательных путей
Средний срок трахеостомии составил 5,4±2,9 суток.Частота развития ВАП в группе пациентов, у которых была выполнена экстубация с последующей реинтубацией, составила 46% (29 из 63 пациентов), по сравнению с пациентами, у которых была выполнена ранняя трахеостомия 36,5% (19 из 52 пациентов). В группе пациентов, у которых была выполнена успешная экстубация, частота ВАП составила всего 13% (6 из 46 пациентов) (таблица №10).
Таблица 10 Влияние неуспешной экстубации на частоту развития ВАП
| Влияние неуспешной экстубации на частоту развития ВАП | |||
| Частота ВАП | |||
| n | % | ||
| Успешная экстубация (n=46) | 6 | 13% | |
| Ранняя трахеостомия (n=52) | 19 | 36,5% | |
| Реинтубация | С последующей экстубацией (n=9) | 4 | 44,4% |
| С последующей трахеостомией
(n=54) |
25 | 46,3% | |
| Всего (n=63) | 29 | 46% | |
Таким образом, можно сделать вывод, что неуспешная экстубация является фактором риска развития ВАП, в связи с чем, актуальной задачей является адаптирование принятых для общереанимационных больных критерием готовности к отлучению от ИВЛ под особенности нейрохирургических больных, что вероятно позволить снизить частоту неуспешных экстубаций и связанных с ними осложнений.При анализе зависимости частоты развития ВАП от причины пролонгирования ИВЛ было выявлено, что частота ВАП была значимо выше в группах пациентов, у которых ИВЛ проводилась в связи с угнетением сознания. Однако однозначно говорить об угнетении сознания как о факторе риска ВАП нельзя, так как большую часть пациентов с угнетением сознания составили пациенты с черепно-мозговой травмой, у которых имелся ряд других, выше перечисленных, факторов риска развития ВАП (таблица №11).
Таблица 11 Зависимость частоты развития ВАП от причины пролонгированной ИВЛ
| Зависимость частоты развития ВАП от причины пролонгированной ИВЛ | ||
| Причина пролонгирования ИВЛ | Частота развития ВАП | |
| n | % | |
| Угнетение сознания (n=101) | 35 | 34,6% |
| Дисфункция ствола (n=52) | 12 | 23,1% |
| Необходимость седации (n=27) | 6 | 22,2% |
| Паренхиматозная дыхательная недостаточность (n=4) | 1 | 25% |
Литература
- Горшков К.М., Горячев А.С., Савин И.А. и соавт. // Интраоперационные и ранние осложнения пункционно-дилятационной трахеостомии у нейрохирургических больных . АИР – 2008 - № 2- С. 75-78.
- Горячев А. С., Савин И. А., Горшков К. М. и соавт. // Журнал Анестезиология-Реаниматология – 2004 – №2- С.58-61. Ранняя трахеостомия у больных с опухолями задней черепной ямки в послеоперационном периоде.
- Горячев А.С., Савин И.А, Пуцилло М.В. и соавт., Нарушения глотания у больных с повреждением ствола головного мозга. Шкала оценки и терапевтическая стратегия. Журнал Вопросы нейрохирургии - 2006 - №4 – С. 27 – 32.
- Горячев А.С., Савин И.А., Горшков К.М. и соавт. // Осложнения пункционно-дилятационной трахеостомии у нейрохирургических больных. - Вестник интенсивной терапии. - 2009 - №2 - С.11-16
- Ошоров А.В. // Использование гипервентиляции в остром периоде тяжелой черепно-мозговой травмы. Автореф. дис. канд.мед.наук. М., 2004
- Buczko W. // Health Care Financ Rev.-2010.-Vol.31(1).- P.1-10.
- Clausen T., Scharf A., Menzel M. et al. - Brain Research – 2004. – Vol. 1019(1-2). –P.113-123
- Efrati S., Deutsch I., Antonelli M. et al. // J Clin Monit Comput.-2010-Vol.24(2).-P.161-8.
- MacIntyre N. R., Branson R. D., Mechanical Ventilation. 2nd Edition 2008
- Pincock S. -2007- Vol.370. – P. 1538