Скачать статью.pdf
Энергетические затраты (ЭЗ), связанные с дыханием, в норме составляют не более 5% общих ЭЗ организма [1—3]. Однако на этапе отлучения от искусственной вентиляции легких (ИВЛ) метаболическая цена дыхания может быть значительно выше [4—6]. ЭЗ организма во время проведения ИВЛ могут быть измерены с помощью методики непрямой калориметрии [7—10]. Обычно непрямая калориметрия используется в отделении реанимации для оценки энергопотребностей при проведении питания пациентов, но также может быть использована для определения метаболической или кислородной цены дыхания [2, 11—14]. Влияние выбора режима ИВЛ на ЭЗ или потребления кислорода изучено в ряде исследований, чаще всего сравнение проводилось между принудительным и спонтанным режимами ИВЛ [15—23]. ЭЗ (или потребление кислорода) в принудительном режиме в той или иной степени практически во всех исследованиях были ниже, чем в режимах с сохраненной спонтанной дыхательной активностью. Менее изученной в настоящее время является проблема изменения ЭЗ при использовании различных уровней респираторной поддержки в спонтанных режимах ИВЛ, хотя именно такие режимы чаще всего используются в период отлучения от длительной ИВЛ [24, 25]. В немногочисленных исследованиях проводилась усредненная оценка метаболических показателей при различных уровнях давления поддержки (PS) в спонтанных режимах ИВЛ [26—28]. Оценка индивидуальных особенностей изменений ЭЗ в ответ на снижение уровня PS в данных работах не выполнена. Наша гипотеза состоит в том, что изменение ЭЗ при изменении уровня PS может существенно отличаться у разных пациентов.
Цель исследования — выявить возможные варианты изменения ЭЗ при снижении уровня респираторной поддержки на этапе отлучения от ИВЛ.
Материал и методы
Исследование выполнено на базе отделения нейрореанимации ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» с 2015 по 2018 г., исследование носило проспективный характер.
Критерии включения в исследование:
— выполненная нейрохирургическая операция;
— ИВЛ в течение не менее 7 суток;
— выполненная трахеостомия;
— вентиляция в спонтанном режиме ИВЛ в течение суток;
— решение лечащего врача о готовности пациента к прохождению теста спонтанного дыхания.
Критерии исключения из исследования:
— признаки дыхательной недостаточности (SpO2 <93% при FiO2 40% и более, требуемое ПДКВ >8 см вод. ст.);
— необходимость вазопрессорной и/или кардиотонической поддержки;
— температура тела выше 38 °C в течение последних суток;
— психомоторное возбуждение (RASS +2 и больше) и/или необходимость постоянной седации;
— избыточная трахеобронхиальная секреция (необходимо более двух санаций трахеи в час);
— отрицательная динамика неврологического статуса (снижение уровня сознания, появления новых очаговых неврологических симптомов в течение последних 3 сут);
— утечка из контура аппарата ИВЛ >5%.
ИВЛ всем пациентам проводилась на дыхательном аппарате Hamilton-G5 («Hamilton Medical AG», Швейцария). Перед началом исследования в дыхательный контур между Y-образным коннектором и трахеостомической трубкой устанавливался датчик потока с портом для забора газов системы анализа газообмена и метаболизма CCM Express («Medical Graphics Corp.», США).
Протокол исследования.
Вентиляция у всех пациентов во время исследования проводилась в спонтанном режиме ИВЛ с поддержкой давлением (pressure support ventilation, PSV), обязательным условием было использование триггера по давлению. Исследование начиналось с PS 20 см вод. ст. Уровень PS последовательно снижался с 20 до 4 см вод. ст. с шагом в 4 см вод. ст. На каждом уровне (20, 16, 12, 8 и 4 см вод. ст.) пациент находился в течение 25 мин. Если уровень PS был избыточен для пациента, то происходило переключение на следующий уровень. Критерии избыточности уровня PS: дыхательный объем более 15 мл на 1 кг массы тела, периоды апноэ более 15 сек, кашель в ответ на вдох аппарата ИВЛ. При недостаточном уровне PS (появление признаков дыхательной недостаточности) вентиляция в режиме PSV прекращалась.
Критерии недостаточного уровня PS: частота дыхания более 35 в мин, SpO2 менее 93%, ЧСС выше 120 в мин или выше 30% от исходной, повышение EtCO2 более чем на 10 мм рт.ст. от исходного уровня, выраженное двигательное беспокойство (по шкале RASS +2 и больше).
Обработка данных. Данные с аппарата ИВЛ и с системы анализа газообмена и метаболизма обработаны и синхронизированы во времени. ЭЗ рассчитаны за каждую минуту вентиляции, для дальнейшего анализа в каждом варианте режима PSV использован промежуток с 5-й по 25-ю минуту вентиляции. Из полученных данных удалены временные промежутки, связанные с такими факторами, как кашель, санация трахеи и др.
Статистический анализ полученных данных проводился с помощью программы IBM SPSS Statistics 23.0. Сравнение Э.З. в различных вариантах режима PSV при анализе всей совокупности пациентов выполнялось с помощью смешанной линейной модели с использованием ковариационной структуры AR (1).
Анализ статистической значимости изменения ЭЗ при снижении PS для каждого отдельного пациента проводился с помощью однофакторного дисперсионного анализа (тест ANOVA). Входными данными для теста являлись ЭЗ за каждую минуту вентиляции (зависимая переменная) и уровень PS (независимая переменная). При выявлении статистически значимых различий далее проводились апостериорные тесты множественных сравнений для определения уровней PS, между которыми имеются статистически значимые различия. Для тестов множественных сравнений использовался либо критерий Тьюки при равенстве дисперсий, либо критерий Геймса—Хоуэлла при неравенстве дисперсий (гомогенность дисперсий оценивалась с помощью теста Левена). Сравнение производилось только между смежными уровнями PS: 20 и 16 см вод. ст., 16 и 12 см вод. ст., 12 и 8 см вод. ст., 8 и 4 см вод. ст.
После выполнения дисперсионного анализа у каждого пациента определялся вариант изменения ЭЗ при снижении PS. Вариант № 1 — повышение ЭЗ: наблюдался как минимум один эпизод статистически значимого повышения ЭЗ при переходе на более низкий уровень PS, при этом отсутствовали эпизоды статистически значимого снижение Э.З. Вариант № 2 — снижение ЭЗ: наблюдался как минимум один эпизод статистически значимого снижения ЭЗ при переходе на более низкий уровень PS, при этом отсутствовали эпизоды статистически значимого повышения Э.З. Вариант № 3 — первоначальное снижение с последующим повышением ЭЗ: наблюдался как минимум один эпизод статистически значимого снижения ЭЗ при переходе на более низкий уровень PS, после чего наблюдался как минимум один эпизод статистически значимого повышения Э.З. Вариант № 4 — отсутствие изменений ЭЗ: отсутствие эпизодов статистически значимого снижения или повышения ЭЗ при переходе на более низкий уровень PS.
Нулевая гипотеза во всех тестах отклонена на уровне значимости 0,05. Данные представлены в виде медианы (25-й квартиль; 75-й квартиль) или среднего и стандартного отклонения в зависимости от типа распределения данных.
Результаты
Возраст пациентов, включенных в исследование, составил 54±12 (от 25 до 75 лет). Из 33 исследуемых было 23 (70%) женщины и 10 (30%) мужчин. Распределение пациентов по основному диагнозу было следующим: опухоли головного мозга — 25 (76%) пациентов, субарахноидальное кровоизлияние — 6 (18%), черепно-мозговая травма — 2 (6%). До начала исследования продолжительность ИВЛ составила 14 (8; 21), от 7 до 31 сут. Причины длительной ИВЛ: низкий уровень бодрствования — у 75% пациентов, бульбарные и псевдобульбарные нарушения — у 25% пациентов.
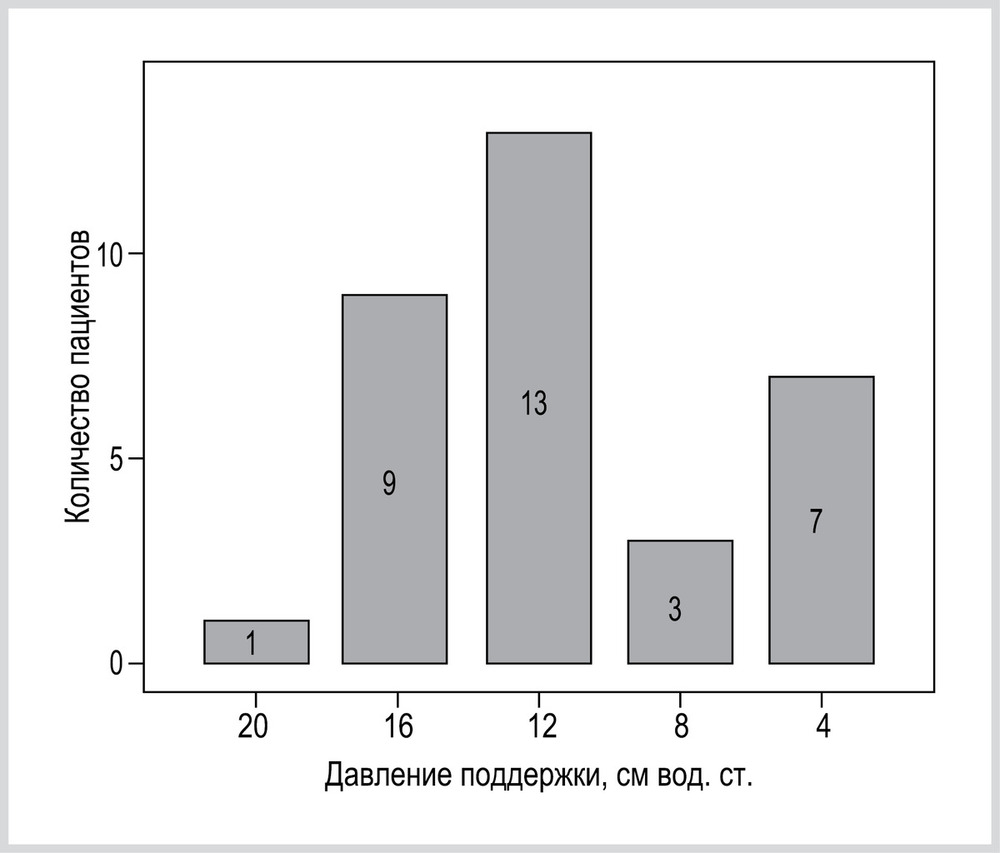
Из 33 пациентов, включенных в исследование, при всех уровнях PS-вентиляция проведена у 6 (18%) пациентов. У остальных 27 (82%) пациентов наблюдались критерии избыточности или недостаточности PS, ИВЛ при данных уровнях PS у этих пациентов не проводилась. Различные варианты комбинаций уровней PS, в которых выполняли ИВЛ, представлены в таблице.

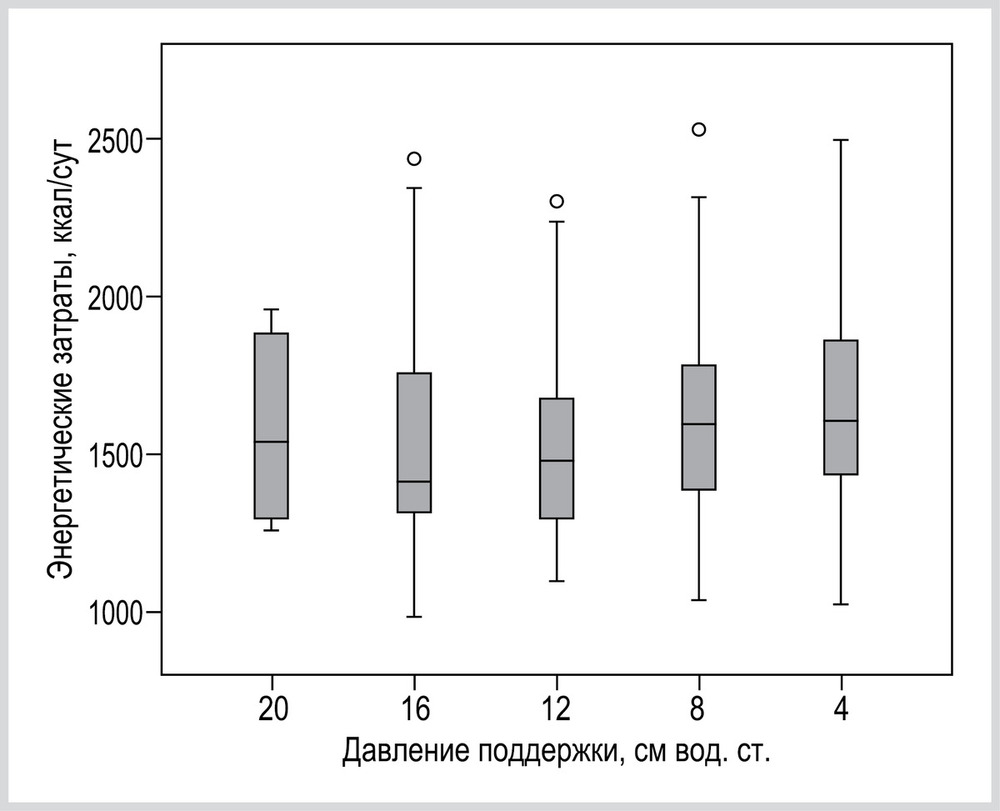
При анализе всей совокупности пациентов ЭЗ при PS 20 см вод. ст. составили 1542 (1287; 1904) ккал/сут, при PS 16 см вод. ст. — 1413 (1306; 1771) ккал/сут, при PS 12 см вод. ст. — 1481 (1294; 1726) ккал/сут, при PS 8 см вод. ст. — 1597 (1382;1807) ккал/сут и при PS 4 см вод. ст. — 1606 (1434; 1870) ккал/сут (рис. 1). Статистически значимых различий между уровнями PS не получено (смешанная линейная модель, p=0,095).
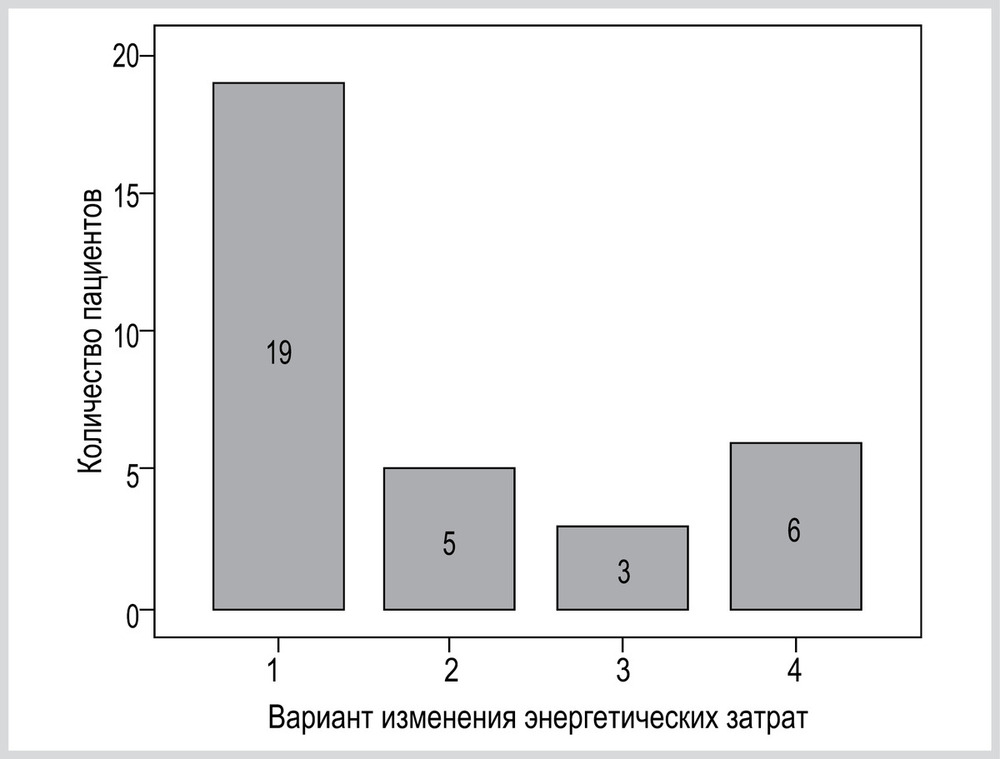
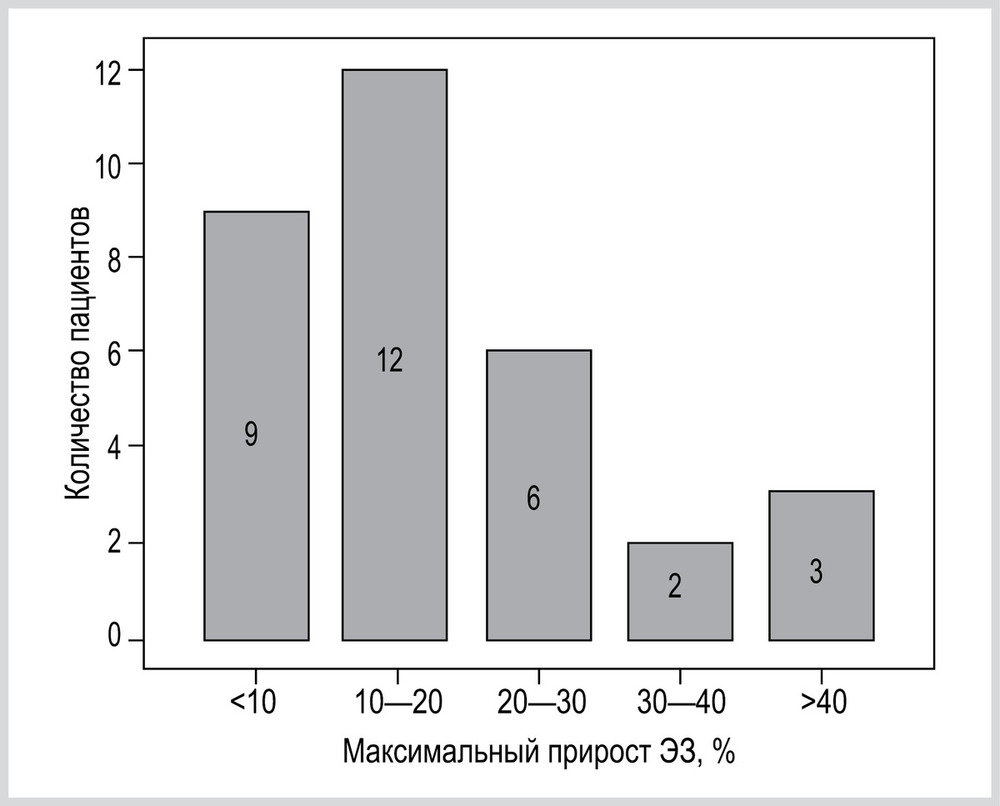
Распределение пациентов в зависимости от максимального прироста ЭЗ представлено на рис. 6.
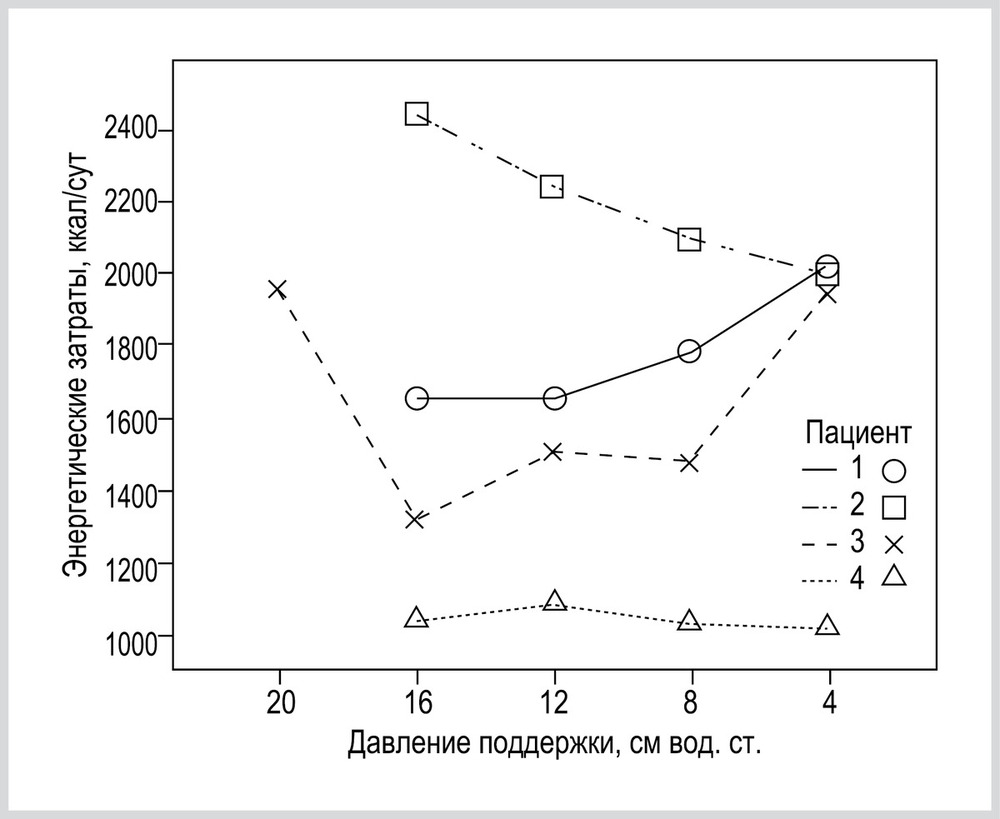
На рис. 7 приведены ЭЗ пациентов, у которых максимальный прирост ЭЗ был более 40%.
Обсуждение
Множество факторов влияют на ЭЗ организма у пациента, находящегося на лечении в отделении реанимации и интенсивной терапии. Факторы, которые непосредственно связаны с механической вентиляцией, — это работа дыхания и респираторный комфорт. У пациента в состоянии глубокой седации и миорелаксации, которому проводится принудительная ИВЛ, ЭЗ, связанные с дыханием, равны нулю [11]. Если спонтанная дыхательная активность не подавляется медикаментозно, то респираторные мышцы начинают выполнять работу, что приводит к росту ЭЗ организма [8, 11]. Работа дыхания в данном случае будет зависеть от состояния дыхательной системы пациента (сопротивления дыхательных путей, растяжимости легких и грудной клетки, величины мертвого пространста, наличия ауто-ПДКВ и др.), используемого оборудования (сопротивления эндотрахеальной трубки и дыхательного контура), настроек аппарата ИВЛ (чувствительность триггера, уровень респираторной поддержки и др.), а также способности дыхательных мышц пациента увеличивать свою работу [26, 29]. В том случае, если дыхательные мышцы пациента не способны генерировать необходимую работу, будут развиваться гипоксемия и/или гиперкапния [26].
Другим важным фактором, который непосредственно влияет на ЭЗ при проведении ИВЛ, является респираторный комфорт [30]. Респираторный комфорт можно определить как отсутствие затруднений при дыхании. Респираторный дискомфорт возникает, когда параметры вентиляции превышают или не достигают того уровня, к которому адаптирован пациент [31]. Возникновение респираторного дискомфорта может приводить к росту ЭЗ за счет возникновения эмоциональных переживаний, двигательного беспокойства и последующей активации симпатоадреналовой и гипоталамо-гипофизарно-надпочечниковой систем [30, 32]. Следует отметить, что респираторный дискомфорт возможен не только при недостаточном, но и при избыточном уровне респираторной поддержки [33, 34].
Приведенные данные, а также результаты выполненных ранее исследований [20—22] указывают на возможную большую индивидуальную вариабельность изменений ЭЗ в ответ на снижение степени респираторной поддержки. Несмотря на это, исследований, в которых бы акцентировали внимание на индивидуальных особенностях изменений метаболических показателей, нами при анализе литературы не найдено.
В работе G. Bellani и соавт. у 28 пациентов проводилась ИВЛ в режиме PSV при уровнях PS 20, 16, 12, 8, 4, 0 см вод. ст. Выявлена общая тенденция для всех пациентов, заключающаяся в том, что потребление кислорода сначала снижается при снижении уровня PS, достигая минимального уровня, а затем повышается. Авторами отмечено, что у некоторых пациентов не было первоначального снижения потребления кислорода, а у некоторых потребление кислорода не изменялось при снижении уровня PS (количество таких пациентов не указано) [26].
В исследовании C. Hormann и соавт. у 14 пациентов вентиляция проводилась при трех вариантах режима PSV (при PS 5,10 и 20 см вод. ст.). Наибольшее потребление кислорода было при уровне PS 5 см вод. ст., при уровне PS 10 см вод. ст. потребление кислорода снижалось, у некоторых пациентов потребление кислорода вновь увеличивалось при повышении PS до 20 см вод. ст. [28].
Авторы обеих работ предполагают, что повышение метаболических показателей при высоких уровнях PS связано с активной работой респираторных мышц, направленной на снижение транспульмонального давления во время вдоха с целью снижения дыхательного объема и/или для обеспечения активного выдоха [26, 28].
В отличие от приведенных выше исследований в выполненной нами работе отсутствовали статистически значимые различия между уровнями PS при анализе всей совокупности пациентов. На наш взгляд, отсутствие общей тенденции изменения ЭЗ обусловлено различными индивидуальными вариантами изменения ЭЗ при снижении PS, которые у разных пациентов могли изменяться в противоположных направлениях.
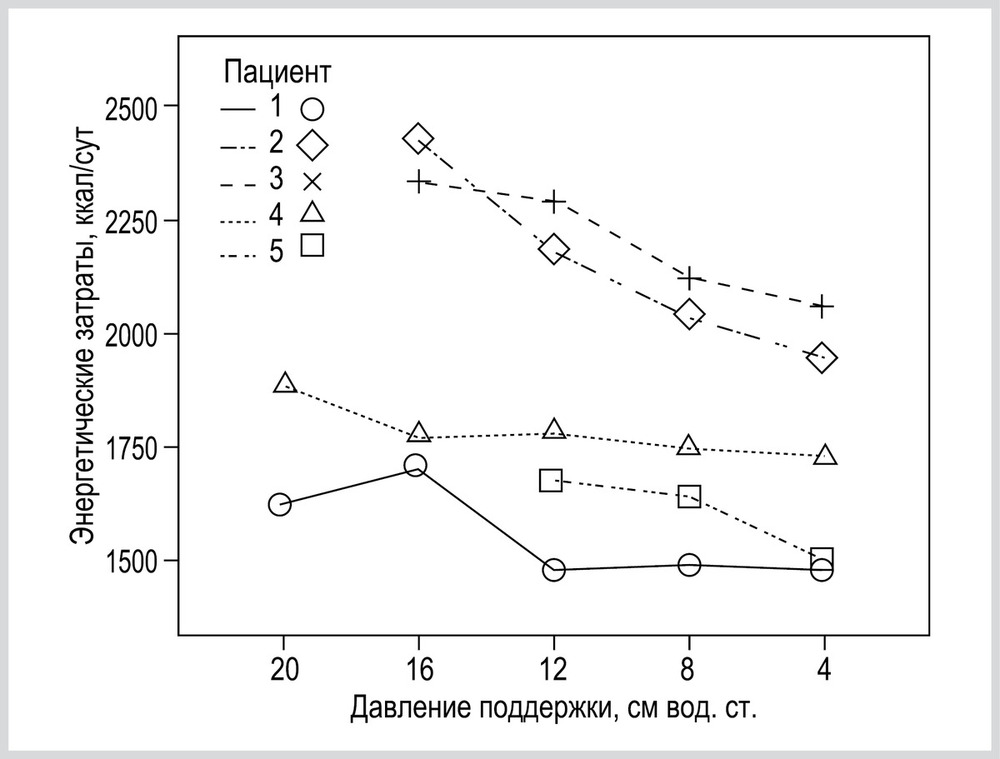
В представленном исследовании описаны 4 варианта изменения ЭЗ. У большинства (67%) пациентов наблюдались варианты № 1 и № 3, которые соответствовали общим тенденциям, описанным в работах G. Bellani и C. Hormann [26, 28]. У остальных пациентов (33%) наблюдались варианты № 2 и № 4 изменения Э.З. Особый интерес представляет выявление у 5 (15%) пациентов снижения ЭЗ при уменьшении уровня PS в режиме PSV (вариант № 2). Подобной тенденции изменения метаболических показателей организма при снижении уровня респираторной поддержки нами в литературе не найдено (см. рис. 4). Мы связываем данный вариант изменения ЭЗ с нарастанием респираторного дискомфорта при высоких уровнях PS. Даже невысокие по общепринятым меркам уровни PS (8—12 см вод. ст.) для некоторых пациентов оказались избыточными.
Минимальные ЭЗ могли наблюдаться при любом уровне PS, чаще всего ЭЗ были минимальными при PS 12 см вод. ст. В исследовании G. Bellani и соавт. также минимальные показатели наблюдались при PS 12 см вод. ст., однако ни у одного пациента не было минимальных ЭЗ при PS 4 см вод. ст. [26]. В то же время в нашем исследовании у 7 пациентов самые низкие ЭЗ были при PS 4 см вод. ст.
Важным результатом анализа индивидуальных изменений ЭЗ в различных вариантах режима PSV была оценка максимального прироста ЭЗ при изменении уровня PS (см. рис. 6). У 12 (36%) максимальный прирост ЭЗ был более 20%. Данные 3 пациентов, у которых максимальный прирост составлял более 40%, в качестве примера представлены на рис. 7.
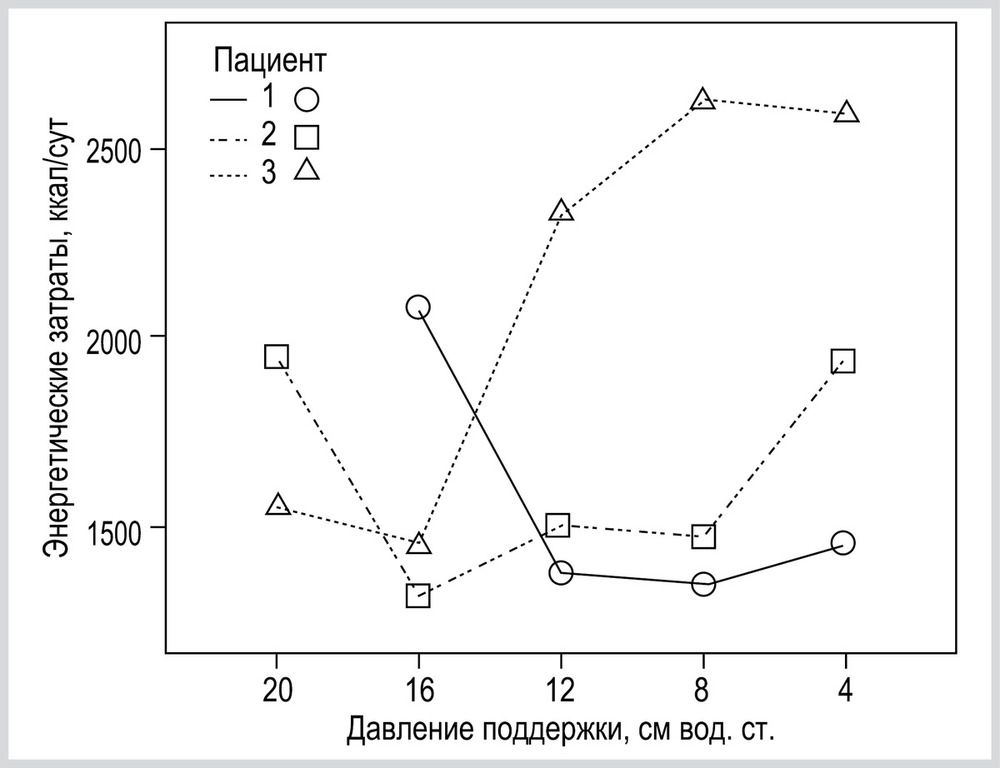
Это обстоятельство, во-первых, само по себе может иметь клиническое значение: очевидно, что применение режима ИВЛ, который существенно увеличивает ЭЗ, является нецелесообразным. Во-вторых, при использовании непрямой калориметрии для оценки энергетических потребностей в питании пациента следует учитывать, что последующее изменение уровня PS может быть фактором, способным значительно изменить ЭЗ организма.
Выполненное исследование имеет ряд ограничений. Во-первых, в работу включено сравнительно небольшое число пациентов. Однако выборки из 33 пациентов оказалось достаточно, чтобы показать существование различных индивидуальных вариантов изменения ЭЗ. Во-вторых, для объективизации индивидуальных изменений ЭЗ при снижении PS использовался однофакторный дисперсионный анализ (тест ANOVA). Входными данными для теста были ЭЗ за каждую минуту вентиляции, которые не являлись полностью независимыми (так как составляли один временной ряд), это могло оказать некоторое влияние на итоговые результаты. В-третьих, дизайн исследования не позволил произвести анализ факторов, которые бы могли влиять на наличие у пациентов того или иного варианта изменения ЭЗ, что может быть предметом дальнейших исследований в этой области.
Заключение
В результате проведенного исследования показано отсутствие универсальной зависимости уровня респираторной поддержки и энергетических затрат организма. Описаны четыре возможных варианта изменения энергетических затрат при снижении уровня давления поддержки в режиме PSV. Минимальные энергетические затраты могут быть при любом уровне давления поддержки (от 20 до 4 см вод. ст.). В ряде наблюдений изменение уровня респираторной поддержки может приводить к относительно большим изменениям энергетических затрат организма (увеличение более чем на 20% относительно минимальных энергетических затрат), причем максимальные энергетические затраты могут наблюдаться при уровнях давления поддержки как ниже, так и выше минимальных.
Финансирование. Исследование не имело финансовой поддержки.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Савченко Я.В. — https://orcid.org/0000-0002-2292-8374
Горячев А.С. — https://orcid.org/0000-0002-6919-5104
Савин И.А. — https://orcid.org/0000-0003-2594-5441
Крылов К.Ю. — https://orcid.org/0000-0002-1807-7546
Бирг Т.М. — https://orcid.org/0000-0001-5935-1233
Полупан А.А. — https://orcid.org/0000-0001-9258-3917
Сатишур О.Е. — https://orcid.org/0000-0002-1404-005X
Список литературы:
- Roussos C, Campbell EJM. Respiratory Muscle Energetics. In: Comprehensive Physiology. John Wiley & Sons, Inc.; 2011.
- Roussos C. Measurment of a work of breathing in critically ill patient. In: Roussos C, ed. The Thorax, Part B: Applied Physiology. New York: Marcel Deccer, Inc.; 1995.
- Lumb A. Pulmonary ventilation. In: Nunn’s Applied Respiratory Physiology. Elsevier. 2016.
- Annat GJ, Viale JP, Dereymez CP, Bouffard YM, Delafosse BX, Motin JP. Oxygen cost of breathing and diaphragmatic pressure-time index. Measurement in patients with COPD during weaning with pressure support ventilation. Chest. 1990;98(2):411-414. https://doi.org/10.1378/chest.98.2.411
- Hubmayr RD, Loosbrock LM, Gillespie DJ, Rodarte JR. Oxygen uptake during weaning from mechanical ventilation. Chest. 1988;94(6):1148-1155. https://doi.org/10.1378/chest.94.6.1148
- Николаенко Э.М. Управление функцией легких в ранний период после протезирования клапанов сердца: Дис... д-ра мед. наук. М. 1989.
- Annat G, Viale JP, Bertrand O, Delafosse B, Bouffard Y, Motin J. Measurement of Oxygen Consumption and Carbon Dioxide Production in Artificially Ventilated Patients. In: Benito S, Net A, eds. Pulmonary Function in Mechanically Ventilated Patients. Berlin, Heidelberg: Springer Berlin Heidelberg; 1991.
- Haugen HA, Chan LN, Li F. Indirect calorimetry: a practical guide for clinicians. Nutrition in clinical practice: official publication of the American Society for Parenteral and Enteral Nutrition. 2007;22(4):377-388. https://doi.org/10.1177/0115426507022004377
- Lev S, Cohen J, Singer P. Indirect calorimetry measurements in the ventilated critically ill patient: facts and controversies — the heat is on. Critical Care Clinics. 2010;26(4):1-9. https://doi.org/10.1016/j.ccc.2010.08.001
- Matarese LE. Indirect calorimetry: technical aspects. Journal of the American Dietetic Association. 1997;97(10)(suppl 2):154-160. https://doi.org/10.1016/S0002-8223(97)00754-2
- Annat G, Viale JP. Measuring the breathing workload in mechanically ventilated patients. Intensive Care Medicine. 1990;16(7):418-421. https://doi.org/10.1007/bf01711217
- Marini JJ. Assessment of the breathing workload during mechanical ventilation. In: Benito S, Net A, eds. Pulmonary Function in Mechanically Ventilated Patients. Berlin, Heidelberg: Springer Berlin Heidelberg; 1991.
- Марченков Ю.В., Лобус Т.В., Савченков С.Б., Арапова О.А. Кислородная цена дыхания как критерий адекватности респиратороной поддержки при переводе больных на самостоятельное дыхание. Анестезиология и реаниматология. 2001;6:12-15.
- Лейдерман И.Н., Грицан А.И., Заболотских И.Б., Крылов К.Ю., Лебединский К.М., Мазурок В.А., Николаенко Э.М., Ярошецкий А.И. Метаболический контроль и нутритивная поддержка у пациентов на длительной искусственной вентиляции легких (ИВЛ). Клинические рекомендации. Анестезиология и реаниматология. 2019;4:5-19. https://doi.org/10.17116/anaesthesiology20190415
- Hoher JA, Zimermann Teixeira PJ, Hertz F, da SMJ. A comparison between ventilation modes: how does activity level affect energy expenditure estimates? JPEN Journal of Parenteral and Enteral Nutrition. 2008;32(2):176-183. https://doi.org/10.1177/0148607108314761
- Savino JA, Dawson JA, Agarwal N, Moggio RA, Scalea TM. The metabolic cost of breathing in critical surgical patients. The Journal of Trauma. 1985;25(12):1126-1133. https://doi.org/10.1097/00005373-198512000-00002
- Swinamer DL, Fedoruk LM, Jones RL, Chin WD, Phang PT, Hamilton SM, King EG. Energy expenditure associated with CPAP and T-piece spontaneous ventilatory trials. Changes following prolonged mechanical ventilation. Chest. 1989;96(4):867-872. https://doi.org/10.1378/chest.96.4.867
- Kemper M, Weissman C, Askanazi J, Hyman AI, Kinney JM. Metabolic and respiratory changes during weaning from mechanical ventilation. Chest. 1987;92(6):979-983. https://doi.org/10.1378/chest.92.6.979
- Shikora SA, Benotti PN, Johannigman JA. The oxygen cost of breathing may predict weaning from mechanical ventilation better than the respiratory rate to tidal volume ratio. Archives of Surgery (Chicago, Ill: 1960). 1994;129(3):269-274. https://doi.org/10.1001/archsurg.1994.01420270045011
- Miwa K, Mitsuoka M, Takamori S, Hayashi A, Shirouzu K. Continuous monitoring of oxygen consumption in patients undergoing weaning from mechanical ventilation. Respiration; International Review of Thoracic Diseases. 2003;70(6):623-630. https://doi.org/10.1159/000075209
- Mitsuoka M, Kinninger KH, Johnson FW, Burns DM. Utility of measurements of oxygen cost of breathing in predicting success or failure in trials of reduced mechanical ventilatory support. Respiratory Care. 2001;46(9):902-910.
- Oh TE, Bhatt S, Lin ES, Hutchinson RC, Low JM. Plasma catecholamines and oxygen consumption during weaning from mechanical ventilation. Intensive Care Medicine. 1991;17(4):199-203. https://doi.org/10.1007/bf01709877
- Ярошецкий А.И., Резепов Н.А., Мандель И.А., Гельфанд Б.Р. Оценка повреждения легких, биомеханики дыхания и рекрутабельности альвеол при вентиляции легких в режиме Pressure Support Ventilation на основе мониторинга трахеального и пищеводного давлений. Анестезиология и реаниматология. 2017;62(2):92-101. https://doi.org/10.18821/0201-7563-2017-62-2-92-101
- Boles JM, Bion J, Connors A, Herridge M, Marsh B, Melot C, Pearl R, Silverman H, Stanchina M, Vieillard-Baron A, Welte T. Weaning from mechanical ventilation. European Respiratory Journal. 2007;29(5):1033-1056. https://doi.org/10.1183/18106838.0104.281
- Hess D. Ventilator modes used in weaning. Chest. 2001;120(suppl 6):474-476. https://doi.org/10.1378/chest.120.6_suppl.474s
- Bellani G, Foti G, Spagnolli E, Milan M, Zanella A, Greco M, Patroniti N, Pesenti A. Increase of oxygen consumption during a progressive decrease of ventilatory support is lower in patients failing the trial in comparison with those who succeed. Anesthesiology. 2010;113(2):378-385. https://doi.org/10.1097/aln.0b013e3181e81050
- Hsu HW, Chen YH, Hsiao HF, Kao KC, Chiu LC, Huang CC. Comparison of the Metabolic Load in Patient Ventilated with Pressure Support Ventilation and Adaptive Support Ventilation Mode with the Same Minute Ventilation. Critical Care: Invasive, Non-Invasive, Conventional, And Non-Conventional Ventilation in Acute Respiratory Failure. 2018;2550-2550.
- Hormann C, Baum M, Luz G, Putensen C, Putz G. Tidal volume, breathing frequency, and oxygen consumption at different pressure support levels in the early stage of weaning in patients without chronic obstructive pulmonary disease. Intensive Care Medicine. 1992;18(4):226-230. https://doi.org/10.1007/bf01709837
- Banner MJ, Jaeger MJ, Kirby RR. Components of the work of breathing and implications for monitoring ventilator-dependent patients. Critical Care Medicine. 1994;22(3):515-523. https://doi.org/10.1097/00003246-199403000-00024
- Hess DR. Mechanical ventilation. In: Hess DR, ed. Respiratory Care: Principles and Practice. 2 ed. Burlington: Jones & Bartlett Learning; 2016.
- Manning HL, Molinary EJ, Leiter JC. Effect of inspiratory flow rate on respiratory sensation and pattern of breathing. American Journal of Respiratory and Critical Care Medicine. 1995;151(3 Pt 1):751-757. https://doi.org/10.1164/ajrccm.151.3.7881666
- Connelly B, Gunzerath L, Knebel A. A pilot study exploring mood state and dyspnea in mechanically ventilated patients. Heart and Lung: the Journal of Critical Care. 2000;29(3):173-179. https://doi.org/10.1067/mhl.2000.105689
- Manning HL, Shea SA, Schwartzstein RM, Lansing RW, Brown R, Banzett RB. Reduced tidal volume increases ‘air hunger’ at fixed PCO2 in ventilated quadriplegics. Respiration Physiology. 1992;90(1):19-30. https://doi.org/10.1016/0034-5687(92)90131-f
- Chonan T, Mulholland MB, Altose MD, Cherniack NS. Effects of changes in level and pattern of breathing on the sensation of dyspnea. Journal of Applied Physiology. 1990;69(4):1290-1295. https://doi.org/10.1152/jappl.1990.69.4.1290