Резюме
В приведенном клиническом наблюдении клипирование аневризмы ПМА-ПСА в остром периоде субарахноидального кровоизлияния САК осложнилось развитием вазоспазма и транзиторного несахарного диабета (НД). Причиной развития НД явилась ишемия передних отделов гипоталамуса в результате спазма передних мозговых и передней соединительной артерий (ПМА-ПСА). Использование стандартного протокола три-Н терапии на фоне НД не приводило к достижению оптимальных показателей гемодинамики и церебрального перфузионного давления из-за развития выраженной полиурии. При дополнении стандартного протокола три–Н терапии заместительной гормональной терапией десмопрессином ацетатом удалось добиться адекватных показателей системной гемодинамики. На этом фоне отмечались стабилизация состояния и регресс вазоспазма. Проявления НД разрешились на фоне восстановления нормальных показателей мозгового кровотока.
По данным Aimaretti G. с сотр., несахарный диабет развивается (НД) у 7,5% больных с субарахноидальным кровоизлиянием (САК) [3]. Развитие НД осложняет течение послеоперационного периода. Qureshi AI. с сотр. доказали, что гипернатриемия, развивающаяся в раннем периоде САК, ассоциирована с неблагоприятным исходом [15].Мы приводим клиническое наблюдение больной с аневризмой передне-мозговой, передне-соединительной артерии (ПМА-ПСА) справа, у которой в остром периоде САК, в раннем послеоперационном периоде развился транзиторный НД.Больная С., 43 лет, поступила в Институт нейрохирургии им. акад. Н.Н. Бурденко с диагнозом рецидивирующее спонтанное субарахноидально-паренхиматозное кровоизлияние с прорывом крови в желудочковую систему. До поступления в Институт в течение двух недель больная перенесла три эпизода субарахноидально-паренхиматозного кровоизлияния с прорывом крови в желудочковую систему, верифицированных клинически и при люмбальной пункции.
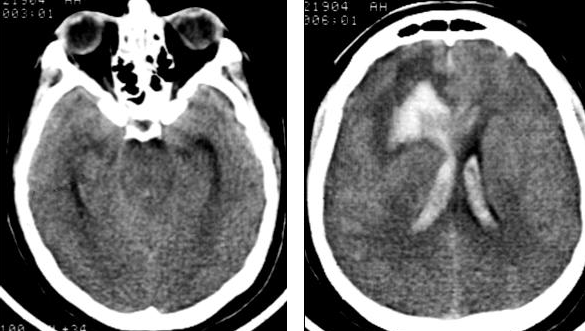
При поступлении состояние оценивалось по шкале Hunt-Hess в 4 балла. Уровень сознания соответствовал сопорозному. Выявлялся выраженный менингиальный синдром. Орально-стволовый синдром проявлялся двухсторонним сужением зрачков, ослаблением фотореакции, ограничением произвольного и рефлекторного взора вверх. Выявлялся левосторонний гемипарез до трех баллов.При компьютерно-томографическом (КТ) исследовании головного мозга были выявлены признаки массивного САК, внутримозговая гематома в лобно-височной области справа с распространением на колено мозолистого тела и прорывом крови в желудочковую систему. Базальные цистерны компремированы (Рис. №2).
По данным транскраниальной допплерографии (ТКДГ), выявлялся резко выраженный вазоспазм. Скорости линейного кровотока представлены в таблице №2.
Таблица №2. Линейная скорость кровотока.
| Сутки Бассейн | До операции | 1-ые | 2-ые | 3-ие | 7-ые |
| СМАd (см/сек) | 200/100 (133) | 190/50 (97) | 220/90 (133) | 250/100 (150) | 200/70 (113) |
| СМАs (см/сек) | 130/40 (70) | 120/40 (67) | 200/80 (120) | 210/90 (130) | 180/80 (113) |
| ПМАd (см/сек) | 100/50 (67) | 110/50 (70) | 150/70 (97) | 170/100 (123) | 150/50 (83) |
| ПМАs (см/сек) | 130/50 (77) | 80/30 (47) | 150/70 (97) | 170/60 (97) | 130/80 (97) |
СМАd – правая среднемозговая артерия; СМАs – левая среднемозговая артерия; ПМАd – правая переднемозговая артерия; ПМАs – левая переднемозговая артерия.
Основными направлениями терапии в предоперационном периоде были поддержание безопасного уровня артериального давления (АДср.=95-100 мм.рт.ст.) и адекватная аналгезия. По лабораторным данным, выявлялась умеренная гипернатриемия до 146-149 ммоль/л. Суточный баланс жидкости был отрицательным, удельный вес мочи составил 1008.
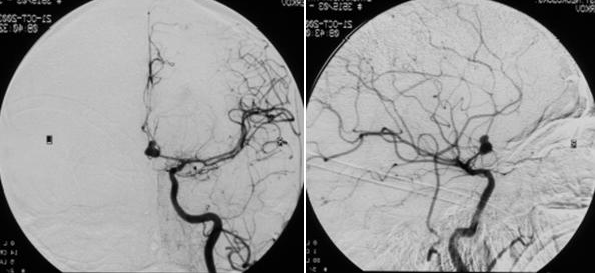
Через 24 часа после поступления при ангиографии была выявлена аневризма ПМА-ПСА справа (Рис. №1) и произведена операция: треппинг-клипирование аневризмы ПМА-ПСА справа (выключена шейка аневризмы вместе с ПСА), с частичным удаление внутримозговой гематомы правой лобной доли и удалением костного лоскута с пластикой твердой мозговой оболочки с целью наружной декомпрессии.
Во время операции визуально и допплерографически выявлялся выраженный спазм обеих ПМА. Были визуализированы сгустки крови, грубые спайки вокруг сосудов основания мозга и в хиазмальной области. На этапе выделения аневризмы произошел ее разрыв. Аневризма была выключена вместе с ПСА (поскольку шейка аневризмы была широкой и включала в себя эктазированную ПСА) на фоне временного клипирования обоих А1-сегментов ПМА в течение 20 минут. Кровопотеря составила около 500 мл, была адекватно восполнена интраоперационно.
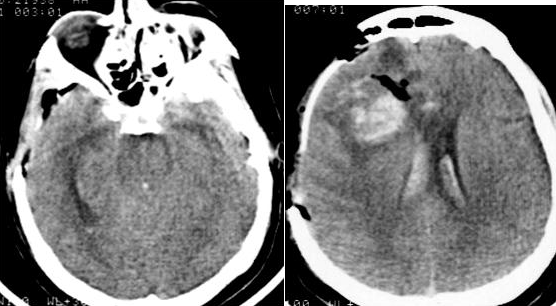
Через два часа после операции выявлялись: угнетение сознания до уровня комы II, орально-стволовый синдром, левосторонний гемипарез. Было выполнено контрольное КТ-исследование, при котором выявлялся отек головного мозга с компрессией базальных цистерн, сохранялась гематома в лобно-височной области справа и желудочковой системе (Рис. №3). По данным ТКДГ, определялось нарастание вазоспазма в бассейнах СМА и ПМА справа (Табл. №2).
Больной проводилась ИВЛ в синхронизированном режиме. Учитывая наличие вазоспазма церебральных артерий, было показано проведение три-Н-терапии. Произведена катетеризация легочной артерии. Использовался стандартный катетер Сван-Ганса диаметром 7,5 Fr. и длиной 110 см. Интродьюссер диаметром 8,5 Fr установили во внутреннюю яремную вену справа. Плавающий катетер был проведен в легочную артерию под контролем формы волн давлений и их значений до получения волны давления заклинивания легочной артерии. Для этого использовался многофункциональный монитор НР-Veridia (США) в его стандартной конфигурации. Сердечный выброс измеряли методом термодилюции. Измерение артериального давления осуществляли прямым способом, катетеризируя лучевую артерию. Непосредственно регистрировались следующие параметры гемодинамики: частота сердечных сокращений (ЧСС); систолическое, диастолическое, среднее артериальное давление (АДсист, АДдиаст, САД); давление в легочной артерии: систолическое, диастолическое, среднее (ДЛАсист, ДЛАдиаст, ДЛАср); давление заклинивания легочной артерии (ДЗЛА); центральное венозное давление (ЦВД); сердечный выброс (СВ). На основании значений полученных параметров рассчитывались общее периферическое сосудистое сопротивление (ОПСС), индексы гемодинамических параметров и показатели работ левых и правых отделов сердца.
В первые часы после операции отмечалась тенденция к относительной артериальной гипотензии (АДср.=70-75 мм.рт.ст.), что требовало применения симпатомиметиков. После катетеризации легочной артерии были выявлены признаки гиповолемии. Динамика показателей центральной гемодинамики и дозы вводимых симпатомиметиков отражены в таблице №1.
Таблица №1. Параметры центральной гемодинамики, вводимые симпатомиметики и их дозы.
| Сутки/ измерение | АД мм.рт.ст. | CИ л/мин/м² | ЧСС уд. в мин. | ЦВД мм.рт. ст. | ДЗЛА мм.рт. ст. | ИОПСС дин*с/(см₅*м²) | Симпатомиметики мкг/кг/мин |
| I/1 | 155/82 (102) | 5,44 | 132 | 3 | 5 | 2692 | Дофамин-14; Фенилэфрин-2. |
| I/2 | 162/81(108) | 5,5 | 91 | 3 | 5 | 2824 | Дофамин-7; Фенилэфрин-2,7. |
| II/1 | 165/78 (104) | 5,45 | 77 | 3 | 5 | 2741 | Дофамин-7; Фенилэфрин-1,6. |
| II/2 | 163/79(107) | 6,7 | 81 | 6 | 10 | 2230 | Фенилэфрин – 1,9. |
| II/3 | 161/76(104) | 6,06 | 69 | 8 | 11 | 2343 | Фенилэфрин – 1,3. |
| II/4 | 162/77(106) | 8,75 | 81 | 8 | 12 | 1657 | Фенилэфрин – 1. |
| III/1 | 169/80 (110) | 7,5 | 73 | 11 | 15 | 1933 | Фенилэфрин – 0,4. |
| III/2 | 170/77(108) | 6,87 | 60 | 12 | 18 | 2067 | - |
| III/3 | 172/81 (111) | 6,9 | 67 | 12 | 18 | 2122 | - |
| III/4 | 180/85(117) | 6,7 | 70 | 12 | 18 | 2296 | - |
АД – артериальное давление; СИ – сердечный индекс; ЧСС – частота сердечных сокращений; ЦВД – центральное венозное давление; ДЗЛА – давление заклинивание легочной артерии; ИОПСС – индекс общего периферического сосудистого сопротивления;Под контролем уровней ЦВД и ДЗЛА проводилась инфузионно-трансфузионная терапия, объем которой в течение первых 12 часов после операции превысил 5000 мл. Темп диуреза был высоким и составлял 3-4 мл/кг/час, развилась гипернатриемия, которая к концу первых суток достигла 171 ммоль/л. Удельный вес мочи был снижен до 1008. Изменения показателей водно-электролитного гомеостаза соответствовали НД, в связи с чем начата заместительная терапия антидиуретического гормона (АДГ) десмопрессином ацетатом. В течение первых 12 часов потребовалось двукратное введение десмопрессина по 0,2 мг через назогастральный зонд. Темп диуреза снизился до 1-1,5 мл/кг/час. Удельный вес мочи на фоне применения десмопрессина составил 1010. Суточный баланс жидкости, доза минирина, концентрация натрия в плазме отражены в таблице №3.
Таблица №3. Суточный баланс жидкости, показатели натрия плазмы и удельного веса мочи, дозы десмопрессина.
| Сутки | Десмопрессин | Баланс жидкости введено/выделено, мл | Na (утро-вечер) | Удельный вес мочи |
| До операции | - | 1850/2400 | 146-149 | 1008 |
| Первые | 0,4 | 5600/3700 | 152-171 | 1008 |
| Вторые | 0,4 | 5125/2200 | 171-158 | 1010 |
| Третье | - | 5500/5000 | 157-151 | 1010-1012 |
| Четвертые | - | 3200/4200 | 156-150 | 1015 |
| Пятые | - | 4350/3500 | 152-147 | 1015-1016 |
| Шестые | - | 4200/3500 | 148-144 | 1014-1016 |
| Седьмые | - | 4000/2800 | 142-144 | 1016 |
Вторые сутки после операции: кома-II, сохранялись грубый орально-стволовый синдром и левосторонний гемипарез. По данным ТКДГ, имело место нарастание вазоспазма в бассейнах СМА и ПМА с обеих сторон (Табл. №2).Продолжалась ИВЛ в режиме SIMV. Вследствие адекватного восполнения объема циркулирующей крови (ОЦК) с достижением оптимальных показателей ЦВД и ДЗЛА введение дофамина удалось прекратить, а дозу фенилэфрина снизить вдвое по сравнению с предыдущими сутками (Табл. №1). Баланс жидкости был положительным на фоне применения десмопрессина в дозе 0,2 мг два раза в сутки (Табл. №3). Концентрация натрия в плазме снизилась до 158 ммоль/л.
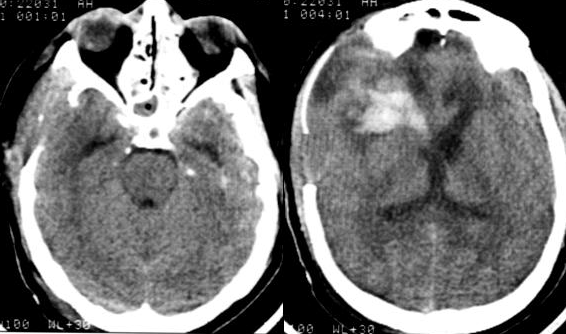
На третьи сутки после операции была отмечена положительная динамика: кома I, частичный регресс левостороннего гемипареза. При проведении КТ-исследования головного мозга выявлены признаки санации ликвора в виде снижения плотности крови в желудочковой системе, уменьшение размеров гематомы правой лобной области. Базальные цистерны прослеживались более четко, зон пониженной плотности вещества мозга выявлено не было (Рис. №4).
Продолжалась ИВЛ в режиме SIMV. Гемодинамически больная была стабильна уже без вазопрессорной поддержки. Инвазивный мониторинг гемодинамики прекращен. Эпизодов полиурии не было. Концентрация натрия в плазме стабилизировалась на уровне 149-151 ммоль/л. Удельный вес мочи составил 1010-1012. Показаний к применению десмопрессина не было.
В период 3-7 суток отмечалась положительная динамика неврологического статуса в виде восстановления сознания и дальнейшего регресса левостороннего гемипареза. По данным ТКДГ выявлено снижение линейной скорости кровотока (Табл. №2).
Была начата дыхательная реабилитация: ИВЛ в режиме СРАР с поддержкой по давлению. Гемодинамика стабильная. Водно-электролитный гомеостаз нормализовался: нормонатриемия, эпизодов полиурии не было, удельный вес мочи составил 1014-1016.
В дальнейшем сохранялась положительная динамика состояния на фоне проведения интенсивной терапии. На 21-ые сутки пациентка из отделения реанимации переведена в нейрохирургическое отделение. Из Института больная выписана в удовлетворительном состоянии.
Приведенное клиническое наблюдение иллюстрирует развитие НД у больной в остром периоде САК после клипирования аневризмы ПМА-ПСА. Наличие НД подтверждалось следующими критериями: гипернатриемия до 171 ммоль/л, высокий темп диуреза, низкий удельный вес мочи, эффективность терапии десмопрессином.
Развитие НД центрального генеза наиболее часто вызывается непосредственным воздействием опухоли на гипоталамо-гипофизарные структуры или их хирургической травмой. По данным литературы, возможно развитие НД у больных с другой нейрохирургической патологией. Aimaretti G. с сотр. показали, что у 7,5% больных с САК развивается НД [3].
НД может развиваться у больных с гигантскими аневризмами ВСА параселлярной локализации, что обусловлено механическим воздействием аневризмы на гипоталамо-гипофизарные структуры головного мозга [4;5;6;7;14;17;18]. Кроме того, описано развитие НД у больных с САК из аневризм ПМА-ПСА в раннем периоде заболевания [8;9;10;11;12;13;16]. Большинство авторов считают, что это осложнение обусловлено ишемическим повреждением вследствие вазоспазма в бассейне ПМА-ПСА. Передние отделы диэнцефальной области, в частности, супраоптическое ядро, где осуществляется синтез АДГ [2], кровоснабжается исключительно ветвями обеих ПМА и ПСА [1,2]. Поэтому ишемическое повреждение диэнцефальной области возможно при развитии спазма обеих ПМА и ПСА.
В описанном нами клиническом наблюдении к ишемии гипоталамо-гипофизарных структур привело развитие вазоспазма вследствие наличия сгустков крови на основании мозга. Факторами, ухудшающими течение вазоспазма были временное клипирование А1-сегментов обеих ПМА и разобщение виллизиева круга.
В описанном наблюдении проведение три-Н-терапии в течение первых 12 часов было неэффективным вследствие высокого темпа диуреза. После диагностики НД был назначен десмопрессин ацетат (минирин). Это дало возможность в течение 24 часов добиться адекватных показателей ЦВД и ДЗЛА, снизить дозу вводимого фенилэфрина, прекратить введение допмина, а еще через 24 часа полностью отказаться от введения симпатомиметиков. Водно-электролитный баланс удалось стабилизировать к третьим суткам. Это совпало с положительной динамикой в неврологическом статусе.
Таким образом, в приведенном выше клиническом наблюдении описан преходящий НД в результате транзиторной ишемии гипоталамо-гипофизарных структур мозга. Своевременная и адекватная заместительная терапия НД позволила проводить три-Н-терапию. Это предупредило ишемическое повреждение диэнцефальных структур мозга с последующим восстановлением механизмов регуляции водно-электролитного гомеостаза.
Итак, анализируя данные литературы и приведенный клинический случай, можно сделать следующие заключения:
- НД у больных с аневризмой ПМА-ПСА может развиваться в первые часы после операции;
- проведение адекватной три-Н-терапии возможно только при адекватной заместительной гормональной терапии НД;
- регресс проявлений НД совпадают с регрессом неврологической симптоматики, обусловленной развившемся вазоспазмом.
Литература
- Беков Д.Б., Михайлов С.С. «Атлас артерий и вен головного мозга человека», М. Медицина, 1979, стр. 95-96.
- Дуус П. «Топический диагноз в неврологии. Анатомия. Физиология. Клиника.», М. ИПЦ «Вазар-Ферро, 1996, под науч. ред. проф. Лихтермана Л.Б., стр. 219.
- Aimaretti G, Ambrosio MR, Di Somma C, Fusco A, Cannavo S, Gasperi M, Scaroni C, De Marinis L, Benvenga S, degli Uberti EC, Lombardi G, Mantero F, Martino E, Giordano G, Ghigo E.: Traumatic brain injury and subarachnoid haemorrhage are conditions at high risk for hypopituitarism: screening study at 3 months after the brain injury. Clin Endocrinol (Oxf), 2004 Sep; 61 (3): 320-6.
- Bihan H, Krivitzky A, Cohen R: Anterior pituitary insufficiency caused by bilateral carotid artery aneurysms. Presse Med 2002 Feb 9; 31(5): 211-3.
- Cartlidge NEF, Shaw DA: Intrasellar aneurysm with subarachnoid haemorrhage and hypopituitarism. J Neurosurg 1972; 36: 640-643.
- Fernandez-Real JM, Fernandez-Castaner M, Villabona C, et al: Giant intrasellar aneurysm presenting with panhypopituitarism and subarachnoid haemorrhage: Case report and literature review. Clin Invest 1994; 72: 302-306.
- Heshmati HM, Fatourechi V, Dagam SA, Piepgras DG: Hypopituitarism caused by intrasellar aneurysms. Mayo Clin Proc. 2001 Aug;76(8): 789-93.
- Kreitschmann-Andermahr I, Hoff C, Niggemeier S, Pruemper S, Bruegmann M, Kunz D, Matern S, Gilsbach JM: Pituitary deficiency following aneurysmal subarachnoid haemorrhage J Neurol Neurosurg Psychyatry 2003;74:1133-1135
- Mac Iver B, Connacher A, Whittle I, et al: Adipsic hypothalamic diabetes insipidus after clipping of anterior communicating artery aneurysm. BMJ 1991; 303: 1465-1467.
- Mac Mahon AJ: Diabetus insipidus developing after subarachnoid haemorrhage from an anterior communicating artery aneurysm. Scott Med J 1988; 33: 208-210.
- Miyasaka Y, Asahi S, Nakayama K, Matsumori K, Beppu T.: Etiology of water and electrolyte metabolism imbalance following the rupture of cerebral aneurysms--with special reference to preoperative condition. No Shinkei Geka. 1984 May;12(6):699-706.
- Nguyen BN, Yablon SA, Chen CY: Hypodipsic hypernatremia and diabetes insipidus following anterior communicating artery aneurysm clipping: diagnostic and therapeutic challenges in the amnestic rehabilitation patient. Brain Inj. 2001 Nov;15(11):975-80.
- Nukta EM, Taylor HC: Panhypopituitarism secondary to an aneurysm of the anterior communicating artery. Can Med Assoc J 1987; 137: 413-415.
- Ooi TC, Russel NA: Hypopituitarism resulting from an intrasellar carotid aneurysm. Can J Neurol Sci 1986; 13: 70-71.
- Qureshi AI, Suri MF, Sung GY, Straw RN, Yahia AM, Saad M, Guterman LR, Hopkins LN: Prognostic significance of hypernatremia and hyponatremia among patients with aneurysmal subarachnoid hemorrhage. Neurosurgery. 2002 Apr;50(4):749-55; discussion 755-6.
- Shibata S, Mori K, Teramoto S: Diabetes insipidus after surgery of intracranial arterial aneurysms – with special reference to the human ADH and aldosterone secretion. No Shinkei Geka. 1978 Aug;6(8):795-801.
- Verbalis JG, Nelson PB, Robinson AG: Reversible panhypopituitarism caused by a suprasellar aneurysm: The contribution of mass effect to pituitary dysfunction. Neurosurgery 1982; 10: 604-611.
- White JC, Ballantine HT Jr: Intrasellar aneurysms simulating hypophyseal tumours. J Neurosurg 1961; 18: 34-50.






