Опухоли хиазмально-селлярной области (ХСО) составляют 15-18% новообразований головного мозга у взрослых [6]. Одними из наиболее значимых осложнений в раннем послеоперационном периоде являются гемодинамические нарушения. Устойчивая артериальная гипотензия (АГ), развивающаяся в ранние сроки после операции, приводит как к вторичному повреждению головного мозга, так и к нарушению перфузии других органов [4, 9, 12]. В доступной литературе мы не нашли данных о частоте развития АГ у больных этой группы.
Причинами снижения АД у больных с опухолями ХСО служат пангипопитуитаризм, гиповолемия, нарушения механизмов центральной регуляции гемодинамики, а также различные их сочетания. Выбор тактики проведения интенсивной терапии для коррекции АГ наиболее адекватен при возможности оценки параметров центральной гемодинамики с помощью катетера Свана-Ганса. Этот метод является «золотым стандартом» мониторинга центральной гемодинамики у больных, находящихся в критическом состоянии [11].
Цель исследования
С помощью инвазивного мониторинга центральной гемодинамики разработать дифференцированный подход к коррекции АГ, требующей применения симпатомиметических препаратов, в раннем послеоперационном периоде у больных с опухолями ХСО.
Материал и метод В исследование включено 10 больных из числа всех оперированных в Институте пациентов в период с мая 2003г. по май 2005г. и соответствующих следующим критериям:
- опухоль ХСО;
- ранний послеоперационный период;
- АГ, требующая применения симпатомиметических препаратов (среднее артериальное давление меньше 70 мм рт. ст.);
- тяжесть состояния, оцениваемая по шкале APACHE II, выше 24 баллов.
Возраст больных – в пределах 35-66 лет (медиана – 48,5), 6 мужчин, 4 женщины. Распределение наблюдений по гистологическому и анатомо-топографическому варианту новообразований представлено в табл. 1.
Таблица 1. Распределение наблюдений по гистологическому и анатомо-топографическому варианту новообразований (n=10)
| Гистологическая характеристика, локализация опухоли | Количество наблюдений |
| Аденомы гипофиза - эндо-супраселлярная локализация - эндо-супра-инфраселлярная локализация - эндо-супра-латеро(D)селлярная локализация |
3 1 1 |
| Краниофарингиомы - интра-экстравентрикулярная локализация - стебельная локализация |
3 1 |
| Лимфома эндо-инфра-супра-латеро(D)-ретроселлярной локализации | 1 |
При развитии АГ на фоне проводимой терапии увеличивали темп инфузионной терапии до 700-900 мл/ч, назначали симпатомиметические препараты, повышали дозы гормональных препаратов: L-тироксин – 2-3 мкг/кг×сут массы тела, гидрокортизон – 700-800 мг/сут, десмопрессина ацетат – 0,4-1,2 мг/сут. Определяли уровни ТТГ, Т3, Т4, их свободных фракций, пролактина, ренина, альдостерона и катехоламинов. Для оценки гемодинамического профиля и коррекции терапии катетеризировали легочную артерию. Использовали стандартный катетер Свана-Ганса (фирма Abbott, США). Интродьюсер фирмы Abbott (США) устанавливали во внутреннюю яремную вену справа. АД измеряли прямым способом, катетеризируя лучевую артерию. Параметры центральной гемодинамики измеряли дискретно, каждые 6 ч. Инвазивный мониторинг продолжали до стабилизации АД, в большинстве наблюдений не более трех суток. Характеристика состояния больных при развитии АГ представлена в табл. 2.
Таблица 2
| ИВЛ – 10 наблюдений |
| Парез желудочно-кишечного тракта – 5 наблюдений |
| Полиурия – 9 наблюдений |
| Гипернатриемия – 9 наблюдений |
| Гипергликемия – 10 наблюдений |
|
Температура тела: - субфебрильная лихорадка – 3 наблюдения - фебрильная лихорадка – 3 наблюдения - гектическая лихорадка – 2 наблюдения - гипотермия – 2 наблюдения |
Методы статистического анализа. Для обработки полученных данных использовали методы непараметрической статистики: тесты Mann-Whitney и Wald-Wolfowitz, непараметрический дисперсионный анализ по Friedman. Сравнение дисперсий осуществляли по методу Фишера. Основным используемым программным продуктом для статистических выводов была “Statistica v. 6.0”.
Результаты и их обсуждение
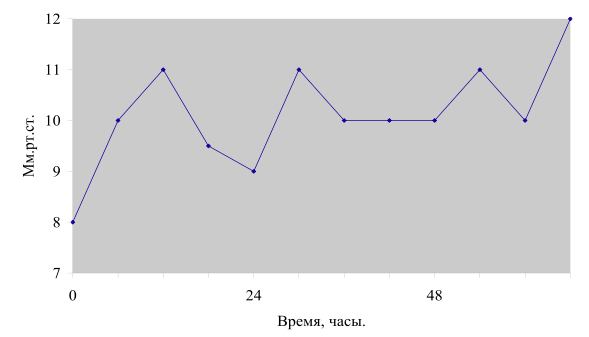
Проведенный статистический анализ показал достоверное (р < 0,05) повышение АДср к концу исследования центральной гемодинамики (рис. 1).
Данные представлены в виде средних значений с логарифмической аппроксимацией.
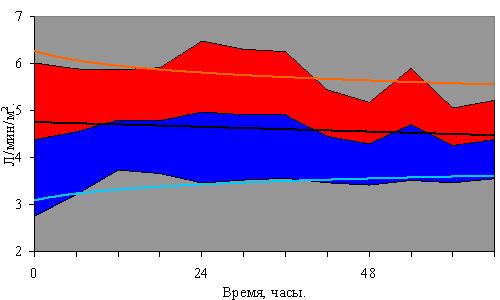
Значения сердечного индекса (СИ) у пациентов составляли 4,62 ± 1,32 (m±sd) л/мин×м2 и не изменялись в течение всего исследования (рис. 2). Таким образом, ни в одном из наблюдений не было признаков сердечной недостаточности.
Данные представлены в виде: среднее значение ± стандартное отклонение. Для каждого показателя приведена логарифмическая аппроксимация.
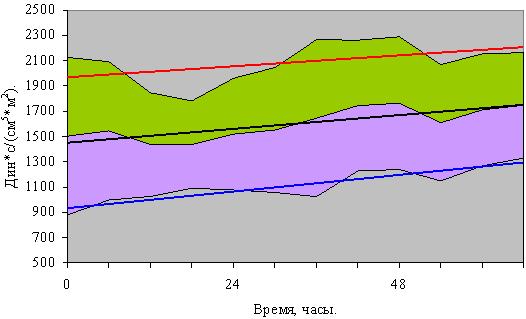
Показатели индекса общего периферического сосудистого сопротивления (ИОПСС) на протяжении всего исследуемого периода были сниженными и составили 1520±495 дин•с/(см5•м²) (рис. 3).
Данные представлены в виде: среднее значение ± стандартное отклонение. Для каждого показателя приведена логарифмическая аппроксимация.
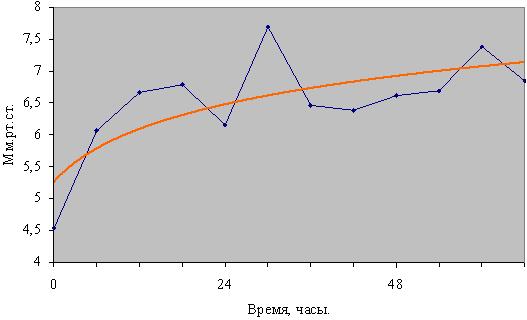
Динамика значений давления заклинивания легочной артерии (ДЗЛА) отражена на рис. 4. Можно сказать о постепенном увеличении ДЗЛА в течение исследуемого периода.
Данные представлены в виде средних значений. Динамика значений центрального венозного давления (ЦВД) представлена на рис. 5. Проведенный статистический анализ показал достоверное (р < 0,05) повышение средних групповых значений ЦВД к концу периода исследования.
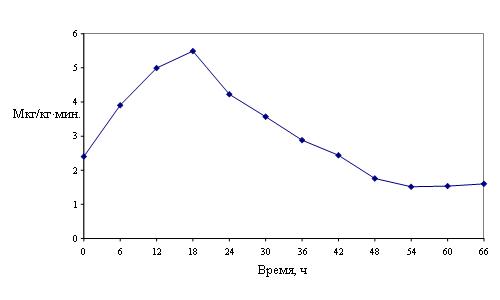
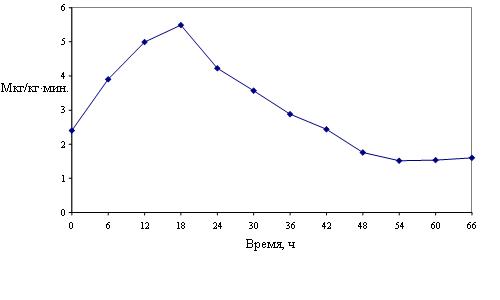
Симпатомиметическим препаратом выбора в проведенном исследовании был фенилэфрин. Динамику используемых доз фенилэфрина иллюстрирует рис. 6. В течение первых суток исследования дозы фенилэфрина увеличивались, достигая максимальных значений (5,5 мкг/кг×мин) в период между 18- и 24-м часом. Затем, в течение вторых суток, дозу фенилэфрина постепенно снижали. На третьи сутки исследования, после 54-го часа, график доз фенилэфрина приобретал вид плато. При этом дозы фенилэфрина достигали 1,5 мкг/кг×мин.
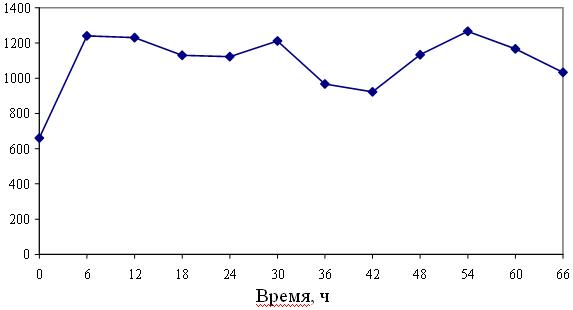
Баланс жидкости на протяжении всего периода исследования был положительным (от +650 до +1250 мл). Это отражено на рис. 7.
Адекватность применяемой гормональной терапии оценивали по клинико-лабораторным признакам (уровень натрия и калия в плазме крови и моче, темп диуреза, удельный вес мочи, температура тела), а также по уровню гормонов в плазме (табл. 3). Дозы гормональных препаратов снижали после стабилизации АД и прекращения инфузии симпатомиметических препаратов.
Таблица 3. Результаты исследования уровней гормонов в плазме
| Сутки |
Гормоны
|
|||||||||
| Т3 | Т4 | свТ3 | свТ4 | КортизолА | АРП | АльдостеронВ | Адреналин С | Норадреналин С | Дофамин С | |
| 1-е | 1,4±1,1 | 87,4±28,8 | 3,2±0,8 | 4,6±1,7 | 726±696 | 1±0,2 | 7,96±0,56 | 179,3±176,1 | 400,1±60,1 | 64,9±56,2 |
| 2-е | 1,1±0,6 | 72,5±15,6 | 2,9±0,8 | 16,7±0,9 | 843±599 | 0,6±0,4 | 40,39±23,46 | 184,3±88,9 | 269,2±35,4 | 107,8±30,3 |
| 3-е | 0,9±0,4 | 74,8±32,1 | 3,1±0,3 | 15,4±0,6 | 730±297 | 0,2±0,07 | 6,23±1,37 | 114,5±85,4 | 229,4±127,7 | 148,4±7,8 |
Значения представлены в виде m±sd; Т3 – трийодтиронин (нмоль/л); Т4 – тироксин (нмоль/л); свТ3 – свободный трийодтиронин (пмоль/л); свТ4 – свободный тироксин (пмоль/л); АРП – активность ренина плазмы (нг/мл•ч); А – нмоль/л; В – пмоль/л; С – пг/мл.
Летальный исход наступил в 4 случаях (табл. 4). В 6 наблюдениях исход был благоприятным.
Таблица 4. Сроки и причины летального исхода
| Наблюдение. | Сроки летального исхода (сутки после операции) | Причина летального исхода |
| 1 | 1-е | Гемотампонада желудочковой системы, дислокационный синдром |
| 2 | 128-е | Тромбоэмболия легочной артерии |
| 3 | 34-е | Сепсис на фоне менингита |
| 4 | 139-е | Сепсис на фоне двусторонней нижнедолевой пневмонии |
В первые сутки проведения инвазивного мониторинга во всех наблюдениях ИОПСС был снижен (рис. 5). СИ – повышен (см. рис. 2). Уровни ДЗЛА и ЦВД позволяли безопасно увеличить темп проводимой инфузионной терапии.
По результатам измерения параметров центральной гемодинамики осуществили коррекцию терапии. Симпатомиметическим препаратом выбора служил фенилэфрин – селективный α-симпатомиметический препарат. Дозу фенилэфрина подбирали по уровню АДср и ИОПСС, к концу первых суток она составила 5,5 мкг/кг•мин. В первые сутки не было показаний для назначения β-симпатомиметических препаратов. В 4 наблюдениях к началу вторых суток исследования в связи с развитием брадикардии терапию дополнили β-симпатомиметическими препаратами. Ударный индекс при этом оставался в пределах нормы. Во всех 4 наблюдениях выявлялись признаки тиреоидной недостаточности. По мнению ряда авторов, развитие брадикардии на фоне применения селективных α-симпатомиметических препаратов обусловлено или рефлекторными механизмами, или их влиянием на α-адренорецепторы миокарда [7]. Таким образом, тиреоидная недостаточность способствует развитию побочных эффектов фенилэфрина. Это является показанием к назначению β-симпатомиметических препаратов.
Во всех наблюдениях выявлялись признаки умеренной гиповолемии. Это позволило увеличить темп инфузионной терапии под динамическим контролем ДЗЛА и ЦВД. Баланс жидкости во время проведения исследования у всех больных был положительным.
В генезе АГ нельзя исключить наличие компонента, связанного с надпочечниковой недостаточностью. Исходя из этого, дозы глюкокортикостероидных гормонов (ГКСГ) увеличивали до максимальных рекомендуемых [1, 6] для больных с пангипопитуитаризмом в условиях тяжелого хирургического стресса. Неэффективность высоких доз ГКСГ можно объяснить несколькими причинами. Во-первых, у больных находящихся в тяжелом состоянии, изменяется концентрация транскортина – кортизол-связывающего глобулина плазмы крови [1, 5]. Во-вторых, возможно снижение концентрации тканевых рецепторов к гормональным препаратам и/или изменение их чувствительности [5]. В-третьих, фармакодинамика синтетических гормональных препаратов отличается от физиологических эффектов эндогенных гормонов [1]. Так, по данным Wolfson et al., экзогенно вводимые ГКСГ неспособны адекватно возмещать дефицит эндогенных ГКС у больных с гипопитуитаризмом в условиях выраженного хирургического стресса и повреждения диэнцефальных структур [13]. По мнению ряда авторов, диагностическая значимость исследования уровня гормонов в плазме как критерия эффективности терапии является низкой [1, 2, 3, 8, 10].
Описанная выше терапевтическая тактика позволила во всех наблюдениях стабилизировать АД в течение нескольких часов. Инвазивный мониторинг в большинстве наблюдений проводился не более 3 сут.
Обращает на себя внимание то, что выявленные в начале исследования сниженные средние значения ИОПСС фактически не изменялись в течение всего периода исследования (рис. 5). При этом отмечали достоверное повышение АДср (рис. 1) и уменьшение дозы применяемого фенилэфрина (рис. 9). Из этого следует, что снижение уровня ИОПСС явилось причиной АГ у исследуемых больных, а увеличение АДср произошло вследствие повышения ИОПСС, что реализовалось снижением дозы фенилэфрина. Средние групповые показатели ИОПСС не достигли нормальных значений. Для объяснения этого феномена требуется проведение дальнейших исследований.
Выводы
- АГ у больных с опухолями ХСО в раннем послеоперационном периоде определяется снижением индекса общего периферического сосудистого сопротивления.
- Стабилизация АД достигалась на фоне применения селективных α-симпатомиметических препаратов, поддержания положительного баланса жидкости и увеличения дозы гормональных препаратов.
- Применение β-симпатомиметических препаратов показано при развитии брадикардии и снижении сердечного индекса вследствие использования селективных α-симпатомиметических препаратов у больных с клиническими признаками гипотиреоза.
- Инвазивный мониторинг гемодинамики с использованием катетера Свана-Ганса позволяет адекватно и безопасно применять симпатомиметические препараты и проводить инфузионную терапию.
Литература
- Дедов И.И., Марова Е.И. Вакс В.В. Надпочечниковая недостаточность (этиология, патогенез, клиника, диагностика, лечение). Москва, 2000
- Barquist E., Kitton O. Adrenal insufficiency in the surgical intensive care unit patient // J. Trauma. 1997. Vol. 42. P. 27-31.
- Bouachour G., Tirot P., Varache N. et al. Hemodynamic changes in acute adrenal insufficiency // Intens. Care Med. 1994. Vol. 20. P. 138-141.
- Chesnut R.M., Marshall L.F., Klauber M.R. et al. The role of secondary brain injury in determining outcome from severe head injury // J. Trauma. 1993. Vol. 34. P. 216-222.
- Cooper M.S., Stewart P.M. Corticosteroid insufficiency in acutely ill patients // New Engl. J. Med. 2003. Vol. 348. P. 727-734.Greenberg M.S. Handbook of neurosurgery. Thieme, 2001. P. 136, 408, 419.Higgins T.L., Steingrub J.S., Kacmarek R.M. et al. Cardiopulmonary critical care. Bios, 2002. P. 112, 116.
- Kidess A.I., Caplan R.H., Reynertson R.H. et al. Transient corticotrophin deficiency in critical illness // Mayo Clin. Proc. 1993. Vol. 68. P. 435-441.
- King B.S., Gupta R., Narayan R.K. The early assessment and intensive care unit management of patients with severe traumatic brain and spinal cord injuries // Surg. Clin. North. Am. 2000. Vol. 80. P. 855-870.
- Pizarro C.F., Troster E.J., Damiani D. et al. Absolute and relative adrenal insufficiency in children with septic shock // Crit. Care Med. 2005. Vol. 33. P. 855-860.
- Shoemaker W.C., Ayres S.M., Grenvik A. et al. Textbook of critical care. 2000. Р. 93.Tator C.H. Ischemia as a secondary neural injury. Neurobiology of Central Nervous System Trauma. New York: OxfordUniversity Press, 1994. P. 209-215.Wolfson A.B. Endocrine and metabolic emergencies. Churchill Livingstone, 1990. P. 174-175.