THE FIRST EXPERIENCE IN MONITORING THE CEREBRAL VASCULAR AUTOREGULATION IN THE ACUTE PERIOD OF SEVERE BRAIN INJURYA. V. Oshorov, I. A. Savin, A. S. Goryachev, K. A. Popugayev, A. A, Potapov, A. G. GavrilovThe paper presents the first experience in monitoring the pressure reactivity index (Prx) of cerebral vascular autoreg-ulation in a group of patients with severe brain injury. This autoregulation index along with the monitored parameters of intracranial pressure (ICP) and cerebral perfusion pressure (CPP) allows the outcome to be predicted in brain injury: the outcome is poor at a Prx of> 0.2. The continuous estimation of the autoregulation index makes it possible to determine the optimum CPP value for each patient and to timely diagnose decompensation of cerebral vascular autoregulation, which is of importance in selecting treatment policy.
Поддержание церебрального перфузионного давления (ЦПД) является важным фактором профилактики вторичной ишемии и независимым прогностическим критерием исхода черепно-мозговой травмы (ЧМТ) [8]. В повседневной практике интенсивной терапии поддержание ЦПД при отеке головного мозга обеспечивается умеренной артериальной гипертензией с использованием катехоламинов и инфузионных растворов [16]. Индуцирование артериальной гипертензии может неблагоприятно сказываться на состоянии травмированного мозга и организма в целом. Использование индуцированной артериальной гипертензии на фоне нарушенной ауторегуляции опасно развитием интраце-ребральных осложнений: нарушение гематоэнцефалического барьера [13], развитие вазогенного отека мозга [6, 14] и индуцированной внутричерепной гипертензии [15]. Подтвержденным фактом является развитие таких экстрацеребральных осложнений при проведении ЦПД-ориентированной терапии, как дисфункция миокарда [11] и повреждение легких с развитием острого респираторного дистресс-синдрома (ОРДС), что значительно увеличивает летальность среди пострадавших и нивелирует первоначальную эффективность ЦПД-протокола [3].
Терапевтическая стратегия, направленная на обеспечение ЦПД, является достаточно агрессивным методом интенсивной терапии и, по мнению ряда авторов, должна быть ориентирована на состояние ауторегуляции мозговых сосудов [10].По данным литературы, частота нарушения ауторегуляции мозговых сосудов при ЧМТ достаточно велика и диагностируется у 47—87% пациентов с ЧМТ [9]. При этом степень нарушения ауторегуляции значительно варьирует — от умеренной до полной утраты, а границы ауторегуляции могут смещаться как к высоким, так и низким значениям ЦПД [1,7, 12, 17].
Диагностика состояния ауторегуляции остается предметом пристального внимания нейроинтенсивистов. Широкое применение для оценки ауторегуляции мозговых сосудов получила транскраниальная допплерография с применением функциональных тестов [1]. Однако данная методика является дискретной и достаточно сложно проецируется на такие параметры нейроинтенсивной терапии, как внутричерепное давление (ВЧД) и ЦПД. Кроме того, использование функциональных тестов при тяжелой ЧМТ может быть ограничено, а в ряде случаев при развитии отека мозга и внутричерепной гипертензии может быть противопоказано.
На сегодняшний день одним из надежных и безопасных методов непрерывной оценки ауторегуляции мозговых сосудов можно считать мониторинг коэффициента реактивности мозговых сосудов на изменение АД (pressure reactivity index — Prx), предложенный британскими исследователями [4]. Метод не требует выполнения функциональных проб и базируется на анализе волновых колебаний АД и ВЧД. Кроме того, метод позволяет проводить расчет оптимального ЦПД [18]. Коэффициент давления реактивности мозговых сосудов (Prx) лучше других методов характеризовал состояние ауторегуляции мозговых сосудов при сравнении различных методов оценки ауторегуляции с использованием позитронно-эмиссионной томографии (ПЭТ) [2]. В нашем отделении эта методика была использована при лечении пострадавших с ЧМТ; предлагаем анализ результатов.
Параметры мониторинга и тяжесть состояния по ШКГ в группах
| Кол-во пациентов | n=5 | n=11 | n=5 |
| Медиана значений | Сохранная ауторегуляцияPrx [-1; 0[ | Частично сохраннаяауторегуляцияPrx [0; 0,2] | Утраченная ауторегуляцияPrx ]0,2; 1] |
| Prx | - 0,15 | 0,07 | 0,3 |
| ВЧД (мм рт.ст.) | 16 | 27 | 33 |
| ЦПД (мм рт.ст.) | 71 | 77 | 67 |
| ШКГ (при поступлении) | 7 | 6 | 5 |
Prx – коэффициент ауторегуляции, ВЧД - внутричерепное давление, ЦПД – церебрально-перфузионное давление, ШКГ – шкала ком Глазго.
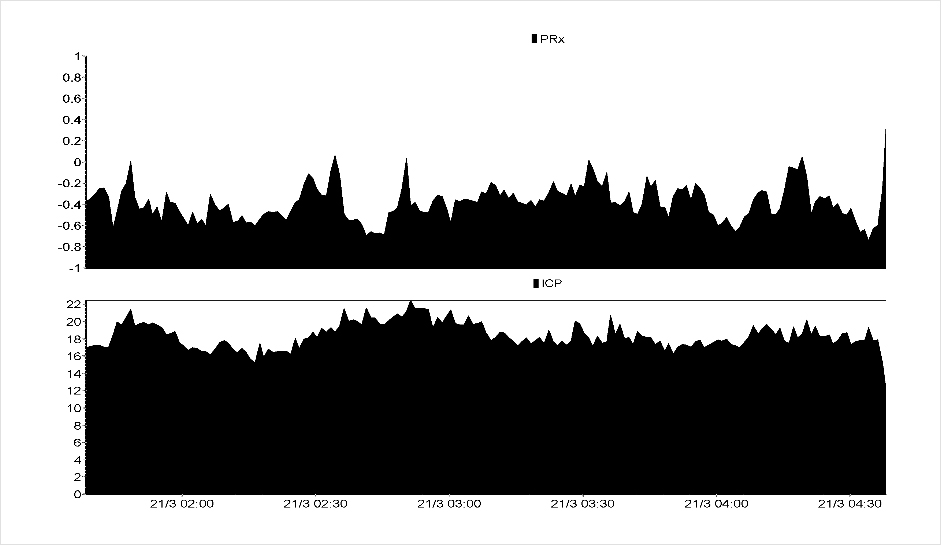
Материалы и методы
Был обследован 21 пострадавший с тяжелой ЧМТ, в возрасте от 16 до 54 лет (медиана 33 года); мужчин было 16 (76%), женщин — 5 (24%). Из 21 пациента 14 (61%) были с изолированной ЧМТ, 7 (23%) — с сочетанной ЧМТ, 10 (48%) - с открытой ЧМТ. Шкала ком Глазго (ШКГ) составила 4—8 баллов (медиана 7 баллов).
При поступлении в Институт им. Н. Н. Бурденко всем пострадавшим выполнялась компьютерная томография (К.Т) головного мозга. По данным КГ у 12 пациентов было выявлено диффузно-аксональное повреждение (ДАП) и очаговые ушибы мозга II—III вида. У 9 пациентов были диагностированы внутричерепные гематомы, по поводу которых они были оперированы в первые сутки после травмы. На 2—4-е сутки с момента госпитализации у 4 (19%) пациентов были выполнены декомпрессивные краниоэктомии с пластикой твердой мозговой оболочки в связи с нарастанием отека мозга и развитием резистентной внутричерепной гипертензии.
Базовые лечебные мероприятия осушествляли в соответствии с международными рекомендациями, основанными на принципах доказательной медицины [8].
В отделении реанимации и интенсивной терапии больным проводились ИВЛ, раСО2 поддерживалось на уровне 30—35 мм рт. ст., раO2 не ниже 100 мм рт. ст., проводилась се-дация, анальгезия (пропофол 1—3 мг/кг/ч или мидазолам 10— 30 мкг/кг/ч, фентанил 10 мкг/кх/ч). ЦПД поддерживалось выше 60 мм рт. ст., при ВЧД выше 20 мм рт. ст. использовали болюсное введение 15% маннитола (0,25—1 г/кг).Основанием для инвазивного мониторинга ВЧД и ЦПД у всех пострадавших были: коматозное состояние, наличие на КТ очаговых или диффузных изменений вещества мозга (отек, очаги ушиба), внутричерепных гематом, а также КТ-признаки внутричерепной гипертензии (сдавление базальных цистерн и желудочковой системы, смещение срединных структур более 5 мм).
У 12 пострадавших с ДАП и очаговыми ушибами мозга датчик ВЧД устанавливали в премоторную зону субдоминантного полушария, из них у 9 субдурально и у 3 интрапаренхиматозно.
У 9 пострадавших после выполнения костно-пластических либо резекционных трепанаций и удаления внутричерепных гематом датчик ВЧД устанавливали на стороне гематомы: субдурально (4 наблюдения) и в одном наблюдении — интравентрикулярно.
Всем пациентам проводилось инвазивное измерение ВЧД и АД. ВЧД измерялось интрапаренхиматозным датчиком "Codman". Инвазивное АД измерялось через катетер, установленный в лучевой артерии или тыльной артерии стопы. Параметры ВЧД, АД, ЦПД регистрировали прикроватным монитором "MERLIN" 1023 фирмы "Hewlett Packard" (США) и усреднялись за 5-секундный интервал с помощью программы по обработке волновых сигналов ICM Plus, Англия [5]. Состояние ау-торегуляции оценивалось по скользящему коэффициенту корреляции Prx с помощью программы ICM Plus, Англия. Данный коэффициент рассчитывался автоматически по 40 последовательным усредненным значениям ВЧД и АД, данный расчет повторялся в пределах скользящего окна каждые 5 с. Значение Prx, как корреляционного коэффициента, находиться в пределах: от —1 до +1. Положительное значение Prx указывает на нарушение ауто-регуляции мозговых сосудов, отрицательное — на сохранный ауторегуляторный ответ.
Длительный мониторинг АД, ВЧД, Prx позволил нам выделить пациентов с сохранной ауторегуляцией — Prx [-1; 0] и нарушенной ауторегуляцией Prx — [0; 1]. Однако в группе пациентов с нарушенной ауторегуляцией мы отдельно выделили пациентов со значением Prx > 0 и < 0,2, так как ранее проведенное исследование установило, что значение Prx > 0,2 является прогностическим фактором неблагоприятного исхода [5]. Таким образом, всех пострадавших распределили на 3 группы в зависимости от значения Prx [-1; 0], [0; 0,2], [0,2; 1].
Исходы оценивались через 6 мес после травмы по шкале исходов Глазго (ШИГ). Благоприятный исход хорошее восстановление — 5 баллов; умеренная инвалидизация — 4 балла. Неблагоприятный исход: глубокая инвалидизация — 3 балла; вегетативное состояние — 2 балла; летальный исход — 1 балл.
Параметры мониторинга и тяжесть состояния по ШКГ в группахРезультаты исследования и их обсуждение.
В 1-ю группу были включены 5 пациентов с коэффициентом Prx в пределах [-1; 0] (рис. 1; см. таблицу). Значение коэффициента Prx указывает на обратную корреляционную зависимость между колебаниями АД и ВЧД и свидетельствует о сохранной ауторегуляции мозговых сосудов. Медиана ВЧД в данной группе составила 16 мм рт. ст., минимальное и максимальное значение ВЧД — 11—28 мм рт. ст. Медиана ЦПД составила 71 мм рт. ст. Длительность мониторинга ВЧД составила от 2 до 4 сут.
Во 2-ю группу были включены 11 пациентов с коэффициентом Prx [0; 0,2]. Значение коэффициента Prx указывает на отсутствие корреляции либо слабоположительную корреляцию АД и ВЧД, что может свидетельствовать о частично сохранной ауторегуляции.
Значение коэффициента ауторегуляции в этой группе в динамике изменялось:уменьшалось и принимало нормальное значение, стремясь к значению Prx [-1; 0];или повышалось, т. е. происходил срыв ауторегуляции Prx > 0,2 (рис. 2).
Медиана ВЧД в данной группе составила 27 мм рт. ст., минимальное и максимальное значение ВЧД составило 19—38 мм рт. ст. Медиана ЦПД составила 77 мм рт. ст. Длительность мониторинга ВЧД составил от 5 до 8 сут.
В 3-ю группу вошли 5 пациентов с утраченной ауторегуляцией. В данной группе коэффициент ауторегуляции Prx находился в пределах [0,2; 1], что указывает на прямую корреляцию ВЧД и АД, а также свидетельствует о полной утрате ауторегуляторных механизмов. Медиана ВЧД составила 33 мм рт. ст., минимальное и максимальное значение ВЧД было 25—48 мм рт. ст. Длительность мониторинга составила от 8 до 11 сут.
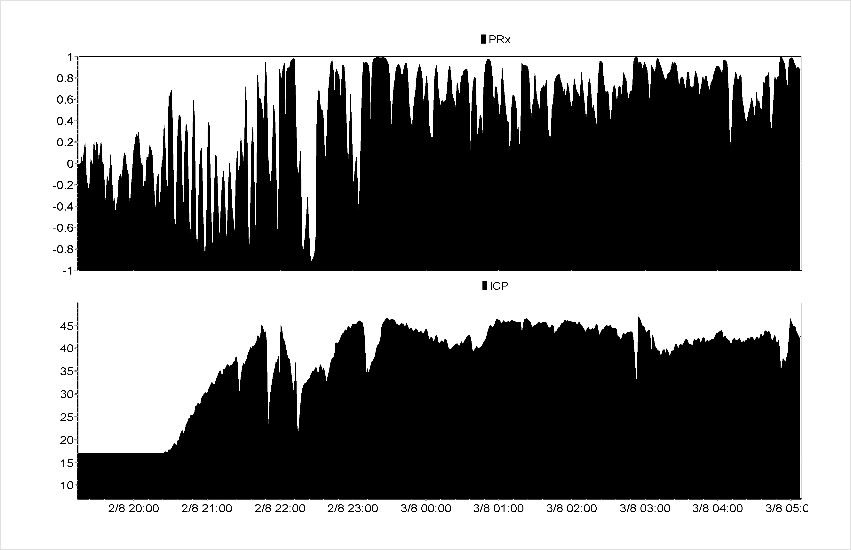
Коэффициент Prx в динамике становится > 0,2, одновременно регистрируется повышение ВЧД.
Структура терапии в группах значительно различалась.
В группе с сохранной ауторегуляцией наблюдались отдельные эпизоды повышения ВЧД, которые купировались углублением седации, кратковременной гипервентиляцией до уровня раСО2 30—33 мм рт. ст. длительностью 10—15 мин и 1—2-кратным введением маннитола в дозе до 0,5 г/кг. Только у одного пациента мы использовали фенилэфрин для стабилизации АД.
Во 2-й группе (с частично сохранной ауторегуляцией) регистрировали частое повышение ВЧД, что требовало использования более высоких доз седативных препаратов (мидазолам, пропофол, диазепам) и наркотических анальгетиков (фентанил, промедол и морфин). В данной группе у 9 пациентов использовали катехоламины для стабилизации гемодинамики и обеспечения заданного ЦПД, причем у 7 больных мы использовали фенилэфрин и у 2 — допамин. У 5 пациентов использовали умеренную и 5 — глубокую ги пер вентиляцию. В данной группе у 8 пациентов использовали маннитол в дозе 0,25—1 г/кг с кратностью введения от 2 до 4 раз в сутки. Наружное вен-трикулярное дренирование использовали у 2 пациентов, барбитураты и гипотермия до 34° — у 1 пациента.
Оптимальное перфузионное давление в данной группе определили у 8 пациентов, что давало ориентир для направленной ЦПД-терапии. Согласно определению L. Steiner и соавт. [18] за оптимальное принимали то значение ЦПД, которое соответствует наименьшему значению коэффициента Prx, т. е., при котором регистрируется наилучший ауторегуляторный ответ мозговых сосудов (рис. 3).
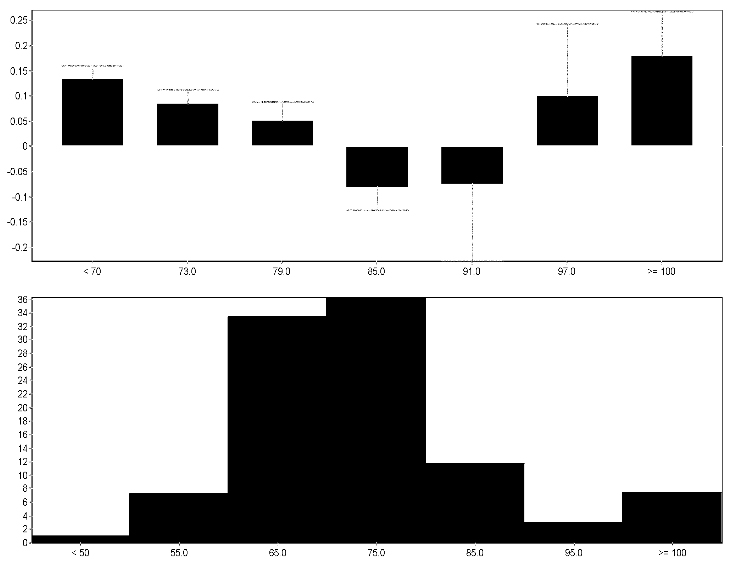
На нижней гистограмме представлено распределение величин ЦПД (ось абсцисс) по отношению к длительности мониторинга (ось ординат, % времени мониторинга). На верхней гистограмме значения ЦПД относительное величины коэффициента аугоре-гуляции Prx. Оптимальное значение ЦПД — это величина перфузионного давления, соответствующая наименьшему значению Prx. Для данного пациента эта величина находится б пределах ЦПД от 85 до 91 мм рт. ст., Prx = -0,1.
На 2—3-й сутки после травмы у двух пациентов наблюдался срыв ауторегуляции мозговых сосудов. Нарушение ауторегуляции регистрировалось на фоне нарастания отека мозга и развития резистентной внутричерепной гипертензии. Срыв ауторегуляции не позволилнам использовать артериальную гипертензию для улучшения церебральной перфузии. Любое повышение системного АД приводило к дальнейшему росту ВЧД, приэтом ЦПД продолжало снижаться либо оставалось неизменным.
В связи с сохраняющейся внутричерепной гипертензией двум пациентам была произведена декомпрессивная кра-ниоэктомия с пластикой твердой мозговой оболочки.
Другие консервативные методы терапии внутричерепной гипертензии были неэффективны либо невозможны.
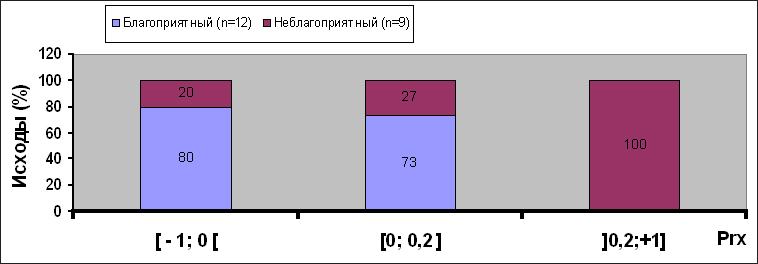
Prx — коэффициент ауторегулнции. Благоприятный исход: хорошее восстановление, умеренная инвалидиэация. Неблагоприятный исход: грубая инвалидизация, вегетативное состояние, смерть. - Гипервентиляция не давала должного эффекта и несла потенциальный риск развития ишемии, так как регистрировалось снижение сатурации крови по данным югулярной оксиметрии SvjO2 < 50%. - Использование маннитола было противопоказано из-за развившейся гипернатриемии и гиперосмолярного синдрома — натрий выше 160 ммоль/л и осмолярность крови выше 320 ммоль/л. - Из-за диффузного отека и сдавления желудочков головного мозга наружное вентрикулярное дренирование у данных пациентов не использовалось.
Структура терапии в группах
| Кол-во пациентов | n=5 | n=11 | n=5 |
| Лечебные мероприятия | Prx [-1;0] | Prx [0;0,2] | Prx [0,2;-1] |
| Катехоламины | 1 (20%) | 9 (82%) | 5 (100%) |
| Умеренная гипервентиляция РаСО2 до 30 мм рт.ст. | 2 (40%) | 5(45%) | нет |
| Глубокая гипервентиляция РаСО2 до 22 мм рт.ст. | нет | 5(45%) | 1(20%)* |
| Маннит (0,25 – 1 г/кг) до 2 раз в сутки | нет | 3(28%) | нет |
| Маннит (0,25 – 1 г/кг) более 2 раз в сутки | нет | 8(72%)** | 5(100%)*** |
| Барбитураты | нет | 1(9%) | 2(40%) |
| Гипотермия (33-34 0 С) | нет | 1(9%) | 2(40%) |
| Дренирование желудочков | нет | 2(18%) | 2(40%) |
| Декомпрессивная трепанация | нет | 2(18%) | 2(40%) |
- * - глубокая гипервентиляция давала кратковременный эффект только у 1 пациента;
- ** - у троих пациентов развилась гипернатриемия и гиперосмолярный синдром, что не позволяло длительно использовать маннит;
- *** - у всех 5 пациентов на 2-3 сутки развилась гипернатриемия и гиперосмолярный синдром.
В 3-й группе (с утраченной ауторегуляцией) у всех пациентов регистрировалась резистентная внутричерепная гипертензия и отмечалась тенденция к артериальной гипотензии, что требовало коррекции с использованием катехоламинов. Причем у трех пациентов из-за устойчивой брадикардии использовали сочетание фенилэфрина и допамина.
Возможности консервативной коррекции внутричерепной гипертензии в этой группе были ограничены. Использование маннитола было возможно только в 1-е сутки, так как начиная со 2-х суток отмечалась стойкая тенденция к гипернатриемии у всех 5 пациентов. Наружное вентрикулярное дренирование возможно было только у 2 пациентов. Глубокая гипервентиляция давала кратковременный эффект только у 1 пациента. У 2 пациентов использовали гипотермию до 33—34°С и длительное введение барбитуратов и у 2 пациентов выполнили декомпрессивную краниоэктомию с пластикой твердой мозговой оболочки.
Исходы в группах представлены на рис. 4. В 1-й группе благоприятный исход зарегистрирован у 4 пациентов. Только один пациент имел неблагоприятный исход в виде глубокой инвалидизации. По нашему мнению, это было связано с тяжестью первичного поражения головного мозга. По данным МРТ у данного пациента диагностировано диффузно-аксональное повреждение с вовлечением подкорковых и стволовых структур мозга. Во 2-й группе благоприятный исход наблюдали у 8 пациентов: 4 имели хорошее восстановление, 4 — умеренную инвалидизацию. У 3 пациентов была глубокая инвалидизация. В 3-й группе у всех пациентов исход был неблагоприятным: 3 пациента умерли, 2 пациента остались глубокими инвалидами.
Представленное распределение исходов подтверждает, что коэффициент Prx может использоваться как дополнительный критерий прогнозирования исхода. В нашем исследовании у всех пациентов с Prx > 0,2 регистрировался неблагоприятный исход.
Заключение
Из-за немногочисленности больных в представленных группах мы не проводили статистической обработки и оценки на достоверность отличий по исходам. Однако по результатам проведенного пилотного исследования можно заключить:во-первых, мониторинг коэффициента Prx позволяет диагностировать сохранность и выраженность нарушения ауторегуляции мозговых сосудов;во-вторых, мониторинг ауторегуляции позволяет прогнозировать исход травмы, а ранняя диагностика декомпенсации ауторегуляции позволяет своевременно менять лечебную тактику;в-третьих, непрерывная оценка ауторегуляции у отдельных пациентов позволяет находить оптимальный уровень ЦПД.
Литература
- Aaslid R., Lindegaard K-F., Sorteberg W. et. al. // Stroke. – 1989. – Vol. 20. – P. 45 - 52.
- Aaslid R., Lindegaard K-F., Sorteberg W. // Stroke. – 2003. - Vol. 34. – P. 2404 - 2409.
- Bullock R., Chesnut R., Clifton G. et al. Guidelines for the management of severe traumatic brain injury. Brain Trauma Foundation. - 1996, 2000, 2007.
- Contant C. F., Valadka A. B., Gopinat S. P. et. al. // J. Neurosurgery. – 2001. – Vol. 95. - P. 560 - 568.
- Czosnyka M., Smielewski P., Kirkpatrick P. et. al. // Acta Neurochir. suppl. – 1998. - Vol. 71. – P. 74 - 77.
- Czosnyka M., Whitehouse H., Smielewski P. et. al. // Int. J. Clin. Monit. Comput. – 1994. – Vol. 11. - P. 223 - 232.
- Durward Q.J., Del Maestro R.F., Amacher A.L. et. al. // J. Neurosurgery. – 1983. - Vol. 59. – P. 803-809.
- El-Adawy Y., Rosner M. J. Intracranial Pressure VII. Berlin: Springer-Verlag. - 1989, pp.829 -833.
- Hlatky R., Furuya Y., Valadka A. et. al. // J. Neurosurgery. – 2002. – Vol. 97. – P. 1054 - 1061.
- Howells T., Elf K., Jones P. A. et. al. // J. Neurosurgery. – 2005. – Vol. 102. – P. 312 - 317.
- Kassell N. F., Peerless S. J., Durward Q. J. et. al. // Neurosurgery. – 1982. - Vol. 11. – P. 337 - 343.
- Lewelt W., Jenkins L. W., Miller J. D. // J. Neurosurgery. -1980. – Vol. 53. P. 500 - 511.
- MacKenzie E. T., Strandgaard S., Graham D. I. et. al. // Circ. Res. – 1976. – Vol. 39. – P. 33 - 41.
- Marshall W.J., Jackson J. L., Langfitt T. W. // Arch. Neurol. – 1969. – Vol. 21. – P. 545 - 553.
- Robertson C. S., Valadka A. B., Hannay H. J. et. al. // Crit. Care Med. – 1999. – Vol. 27. – P. 2086 - 2095.
- Rosner M. J., Daughton S. // J. Trauma. – 1990. – Vol. 30. - P. 993 - 940.
- Rosner M. J., Rosner S. D., Jonson A. // J. Neurosurgery. -1995. – Vol. 83. – P. 949 – 962.
- Steiner L., Czosnyka M., Piechnik S. et. al. // Crit. Care Med. – 2002. - Vol. 30. - P. 733 - 738.






