Резюме
Цель исследования: оценка методом непрямой калориметрии метаболического ответа организма на тяжелую черепно-мозговую травму. В исследование вошли 23 пациента с черепно-мозговой травмой. Протокол исследования включал: измерение антропометрических показателей – роста и массы тела, измерение потерь азота, выявление и оценка степени катаболизма, расчет энергетических потребностей пациента по потерям азота с мочой, определение энергетических затрат покоя (ЭЗП) методом непрямой калориметрии. Было проведено 67 исследований. Величина ЭЗП варьировала от 54% до 214% от расчетных значений. Для точного расчета нутритивных потребностей пациентов в остром периоде черепно-мозговой травмы следует проводить оценку ЭЗП и необходимых потребностей в энергии и белке с помощью метаболического мониторинга.
Черепно-мозговая травма (ЧМТ) является социально значимым заболеванием, от которого страдает по большей части трудоспособная часть населения, поэтому большое значение придается разработке и внедрению стандартов, протоколов и принципов диагностики и лечения ЧМТ. Наряду с экстренными мероприятиями по поддержанию основных функций организма и предотвращения вторичных осложнений, важная роль отводится и нутритивной поддержке пациентов с ЧМТ [3, 4, 12].
В настоящее время сформулировано несколько принципов назначения нутритивной поддержки больным в остром периоде тяжелой ЧМТ: расчет потребностей в энергии на килограмм массы тела, расчеты по потребностям белка, расчет необходимых энергетических потребностей по потерям азота [1, 4, 5, 12]. Однако ЧМТ – тяжелое заболевание, приводящее к изменению метаболизма и его структуры, что делает крайне затруднительным оценку необходимых потребностей расчетными методами.
Цель исследования
Целью нашего исследования явилась оценка методом непрямой калориметрии метаболического ответа организма на тяжелую ЧМТ.
Материалы и методы исследования.
Нами выполнено проспективное, когортное исследование, включающее в себя 23 пациента с ЧМТ, последовательно включенных в исследование в период с января 2010 по декабрь 2011 г., и соответствующих критериям включения. Критерии включения и исключения. В исследование включались проспективно все пациенты с диагнозом острая тяжелая ЧМТ, поступившие в Институт не позднее, чем на 7 сутки от момента получения травмы с уровнем нарушения сознания по Шкале Комы Глазго (ШКГ) 7 баллов и менее. Из исследования исключали пациентов, имеющих следующие факторы и сопутствующие заболевания. Уровень сознания по ШКГ более 7 баллов или менее 4 баллов.
Тяжелая сочетанная травма.
Наличие у пациента сопуствующей патологии в виде печеночной или почечной недостаточности, делающими невозможным проведение оценки нутритивного статуса. Диаррейный синдром, делающим невозможным корректный учет потери азота. Наличие противопоказаний для проведения искусственного питания: острейшая фаза повреждения – 12–24 ч; рефрактерный шок; уровень сывороточного лактата >3–4 ммоль/л; гипоксия – рО2 <50 мм рт. ст; ацидоз – рН <7,2, рСО2 > 80 мм рт. ст. Психо-моторное возбуждение. Негерметичность манжеты интубационной или трахеостомической трубки, утечка в контуре «пациент–аппарат». Наличие у пациента тремора и судорог. Бронхоплевральный свищ. Процентное содержание кислорода во вдыхаемой смеси более 60%, или нестабильность фракции кислорода во вдыхаемом воздухе. Гипервентиляция (респираторный коэффициент более 1,2). Уровень положительного давления в дыхательных путях в конце выдоха ≥12 см H2O.
Проведение гемодиализа.
Все пациенты трудоспособного возраста от 18 до 63 лет (средний возраст составил 35 лет) и до поступления в клинику не имели сопутствующей патологии, без признаков истощения. Как правило, все пациенты поступали в клинику с изолированной ЧМТ либо с незначительной сочетанными травмами (переломы ребер, длинных трубчатых костей, переломы челюсти и т.п.). По половому признаку пациенты распределились следующим образом – мужчины – 16 и женщины – 7 человек.
Состояние пациентов оценивали при поступлении. Проводили детальный неврологический осмотр с определением уровня сознания. Во время осуществления основного лечебного процесса, когда требовались коррекция внутричерепной гипертензии и поддержание систем гомеостаза, пациентам проводили продолженную седацию путем внтуривенной инфузии препаратов для анестезии (пропофол, фентанил и т.п.). У этих пациентов неврологический статус не оценивали.
После проведения оценки нутритивного статуса и метаболических потребностей при условии отсутствия критериев исключения пациенту назначали нутритивную поддержку из расчета 25 ккал/кг массы тела в сутки, с постепенным увеличением энергетической нагрузки до 35–50 ккал/кг массы тела в сутки к 14–21 суткам. Питание начинали стандартными гиперкалорическими смесями с пищевыми волокнами (Нутризон Энергия с Пищевыми Волокнами, 1,5 ккал/мл, «Нутриция»), после проверки функции желудочно-кишечного тракта, через назогастральный зонд. При необходимости, в случае нарушения толерантности к проводимому энтеральному питанию пациента переводили на смешанное питание (энтеральное/парентеральное).
Исследование проводили по следующей программе.
Измерение антропометрических показателей – роста и массы тела. Измерение потерь азота, выявление и оценка степени катаболизма. Методика представляет собой сбор суточной мочи у пациента и определение общего количества мочевины в суточной моче. Потери азота рассчитываются по известной формуле: Потери азота(г/сут)= (Мочевина мочи (ммоль/л) Х объем мочи (л) Х 28/1000) +6 [1] С целью выявления катаболизма у пациентов после получения данных об общей потере азота по формуле рассчитывали азотистый баланс. Этот показатель характеризует потери азота организмом и степень белкового катаболизма (табл.).
Таблица. Степень тяжести катаболизма [1]. 
| Степень катаболизма | Величина потерь азота (г/сутки) |
| Норма | Нет |
| Легкий | До 6 |
| Средней тяжести | 7-12 |
| Тяжелый | Более 12 |
Азотистый баланс = поступивший азот (г/сут) – общие потери азота (г/сут) [1] Определение энергетических затрат покоя (ЭЗП) методом непрямой калориметрии (НК). Метод заключается в определении объема потребленного кислорода (Vo2) и объема выделенного углекислого газа (Vсо2) [2]. Исследования метаболизма методом непрямой калориметрии проводили на системе анализа газообмена и метаболизма CCM Express компании MedGraphics, США. Непосредственно перед исследованием пациента в интерфейсную программу прибора вносили основные данные пациента (паспортная часть, индивидуальный номер, антропометрические данные, режим и показатели вентиляции, состояние сознания пациента). Исследование проводили в течение минимум 30 мин у каждого пациента. После окончания исследования вносили данные о величине общих потерь азота за сутки.
Всего по стандартной программе у 23 пациентов было проведено 67 исследований.
Результаты исследования и их обсуждение.
У пациентов при поступлении в клинику индекс массы тела в среднем составил 27,64±4,45 кг/м2 (норма 20–25,9). У 2/3 пациентов отмечали катаболизм тяжелой или средней степени выраженности, в оставшихся наблюдениях катаболизм у пациентов отсутствовал или был легкой степени выраженности. Известно, что катаболизм – это разрушение собственных запасов белка (преимущественного мышечной массы) с целью обеспечения белково-энергетических потребностей организма в отсутствии пищи. В ходе стресс-голодания это процесс протекает более быстро и тяжело [5]. Наиболее ярким признаком катаболизма, помимо резко отрицательного азотистого баланса, является быстрая потеря мышечной массы тела пациентами.
При анализе зависимостей между сроками получения ЧМТ и величиной энергозатрат покоя и респираторного коэффициента (РК) не было выявлено значимых закономерностей. Наше исследование метаболизма выявило высокую вариабельность как показателей энергетических затрат покоя, так и респираторного коэффициента. Величина ЭЗП варьировала от 1152 ккал/сут до 3158 ккал/сут, что составляло от 54% до 214% от расчетных значений. При том, что большинству пациентов, особенно в острейшем периоде, проводили продленную седацию.
На рисунке 1 показана динамика ЭЗП, измеренных методом НК в процентном соотношении от расчетных величин у двух, идентичных по тяжести, пациентов, поступивших в остром периоде тяжелой ЧМТ. На рисунке видно, как метаболизм у Пациента «Ф» остается в пределах нормальных значений, в то время как метаболизм пациента «А», повышается до двух раз от контрольных значений.
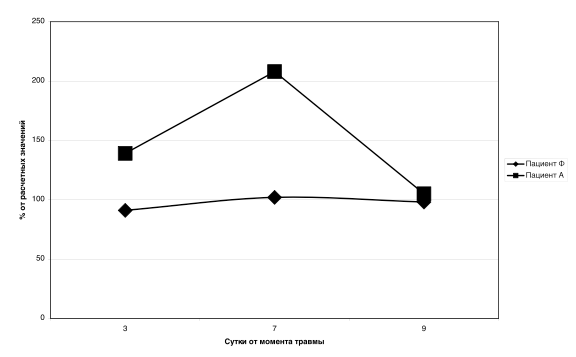
Наши результаты совпадают с заключением обзора N. Foley et al. [7] включающем в себя 24 исследования, три из которых были рандомизированными контролируемыми исследованиями. Установлено, что уровень энергозатрат покоя варьировал у пациентов с тяжелой ЧМТ от 75% до 200% от расчетных значений, причем минимальный уровень энергозатрат покоя был зафиксирован у пациента с погибшим мозгом. Проведенный обзор литературы K. Krakau et al., основанный на 30 исследованиях, показал, что скорость обмена веществ у пациентов с тяжелой ЧМТ варьировала от 96 до 160% [10].
Проведенный анализ данных выявил слабую корреляцию (y=1153,5 + 0,374*x; r=0,628; p<0,0001; r2=0,39) расчетных показателей ЭЗП, полученных стандартным уравнением Харриса–Бенедикта на основании антропометрических данных, и данных, полученных в результате проведения измерения методом непрямой калориметрии (рис. 2). Уравнение Харриса–Бенедикта было выведено в 1919 г., на основании данных полученных методом НК у здоровых добровольцев [9].
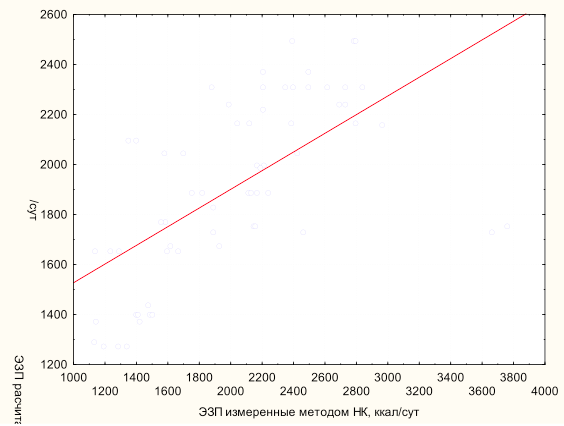
Рядом авторов также была сделана попытка провести корреляционный анализ между расчетными значениями уровня энергозатрат покоя и измеренными с помощью метода непрямой калориметрии [7, 11]. В исследовании P. M. Sunderland et al. проведенный анализ показал слабую зависимость между расчетными и измеренными показателями ЭЗП [14]. Очевидно, что использование этого уравнения допустимо только у нетяжелых больных для оценки их метаболизма.
Современные мировые тенденции диктуют необходимость отказываться от стандартизации расчетов белково-энергетических потребностей пациента и все больше делать акцент на индивидуализацию определения и назначения рациона питания. P. Singer et al. в своем исследовании показали снижение госпитальной смертности у пациентов, которым проводили динамический метаболический мониторинг энергозатрат покоя методом непрямой калориметрии [13]. Мы также придерживаемся мнения, что индивидуальный подход к осуществлению нутритивной поддержки пациентов в критическом состоянии позволяет избежать не только недостаточного поступления энергетических и пластических материалов в организм, но и риска их чрезмерного поступления. Нельзя осуществлять питание пациента в критическом состоянии по принципу «чем больше, тем лучше». Чрезмерное поступление в организм пациента энергетических субстратов сопряжено с рядом осложнений, таких как: увеличение частоты вторичных инфекций, дисфункция печени, гипертермия, гипергликемия, гипертриглециридемия и перегрузка жидкостью [6, 8].
В заключение стоит отметить, что методика определения ЭЗП методом непрямой калориметрии требует специальных навыков, равно как и корректное определение потерь азота. Однако для получения более высокого качества лечения пациентов в остром периоде ЧМТ следует опираться на правильное и точное определение необходимых потребностей в энергии и белке. При невозможности использования метода непрямой калориметрии у пациентов в остром периоде тяжелой ЧМТ, возможно использование уравнения Харриса–Бенедикта. Однако не следует оставлять без внимания тот факт, что такой метод расчета ЭЗП может допускать значительную ошибку. Необходимо проведение дальнейших исследований с оценкой взаимосвязи между величиной ЭЗП, структурой метаболизма и стрессовыми факторами, такими, как вторичная инфекция, внутричерепная гипертензия и др.
Выводы.
При оценке метаболизма методом непрямой калориметрии у пациентов в остром периоде черепно-мозговой травмы выявляется высокая вариабельность показателей энергетических затрат покоя, не зависящая от сроков получения травмы.
В ходе проводимого исследования выявляется слабая корреляция (y = 1153,5 + 0,374*x; r=0,628; p<0,0001; r2=0,39) расчетных показателей ЭЗП полученных стандартным уравнением Харриса–Бенедикта на основании антропометрических данных и данных, полученных в результате проведения измерения методом непрямой калориметрии.
В 2/3 наблюдений у пациентов с тяжелой черепно-мозговой травмой развивается катаболизм тяжелой или среднетяжелой степени тяжести.
В связи с установленной вариабельностью нарушений метаболизма, выявленных при измерении ЭЗП методом непрямой калориметрии, и невозможностью расчетным методом по стандартному уравнению Харриса–Бенедикта оценить нарушение структуры метаболизма, всем пациентам в остром периоде тяжелой черепно-мозговой травмы необходимо проводить динамический метаболический мониторинг методом непрямой калориметрии.
Литература
- Бутров А.В., Попова Т.С., Свиридов С.В., и др., Парентеральное питание в интенсивной терапии и хирургии: Методические рекомендации. Москва. – 2006. – C. 10-18.
- Завертайло Л.Л., Мальков О.А, Лейдерман И.Н. Технология метаболического мониторинга и выбор программы нутритивной поддержки у больного в критическом состоянии // Интенсивная терапия. – 2007. – Т. 1. – С. 65-77.
- Коновалов А.Н., Лихтерман Л.Б, Потапов А.А. Черепно-мозговая травма. Клиническое руководство. В трех томах. – Москва. Антидор. 1998-2002.
- Никифоров А.С., Коновалов А.Н., Гусев Е.И Клиническая неврология». Том III. Часть 1. Москва. Медицина. – 2004. – С. 418-459.
- Руководство по клиническому питанию. Под редакцией Луфта В.М., Багненко С.Ф., Щербука Ю.А. Санкт-Петербургский НИИ скорой помощи им. И.И. Джанелидзе. – Санкт-Петербург. – 2010. – С. 94-114.
- Dissanaike S., Shelton M., Warner K. et al. The risk for bloodstream infections is associated with increased parenteral caloric intake in patients receiving parenteral nutrition // Crit. Care. – 2007. – Vol. 11. – P. R114.
- Foley N., Marshall S., Pikul J. et.al. Hypermetabolism following moderate to severe traumatic acute brain injury: a systematic review // J. Neurotrauma. – 2008. – Vol. 25. – P. 1415-1431.
- Grau T., Bonet A. Caloric intake and liver dysfunction in critically ill patients // Curr. Opin. Clin. Nutr. Metab. Care. – 2009. – Vol. 12. – P. 175-179.
- Harris J.A., Benedict F.G., Biometric studies of human basal metabolism // Proc Natl Acad Sci U S A. – 1918. – Vol. 4 – P. 370-373.
- Krakau K., Omne-Pontén M., Karlsson T. et.al. Metabolism and nutrition in patients with moderate and severe traumatic brain injury: A systematic review // Brain Inj. – 2006. – Vol. 20. – P. 345-367.
- McEvoy C.T., Cran G.W., Cooke S.R. et al. Resting energy expenditure in non-ventilated, non-sedated patients recovering from serious traumatic brain injury: Comparison of prediction equations with indirect calorimetry values // Clinical Nutrition. – 2009. – Vol. 28. – P. 526-532.
- Povlishock J.T., Bullock M.R., Hillered L.T. et аl. Guidelines for the Management of Severe Traumatic Brain Injury 3rd Edition // J. neurotrauma. – 2007. – Vol. 24. Suppl. 1. – P. S77-S82.
- Singer P., Anbar R., Cohen J., et al. The tight calorie control study (TICACOS): a prospective, randomized, controlled pilot study of nutritional support in critically ill patients // Intensive Care Med. – 2011. – Vol. 37. – P. 601-609.
- Sunderland P.M., Heilbrun M.P. Estimating energy expenditure in traumatic brain injury: comparison of indirect calorimetry with predictive formulas // Neurosurgery. – 1992. – Vol. 31. – P. 246-252.






