НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Введение
Первые отделения интенсивной терапии (ОИТ), где использовалась длительная ИВЛ для спасения жизни пациентов и лечения заболевания, были созданы в Европе в 1952 во время эпидемии полиомиелита. По существу первые ОИТ были отделениями нейроинтенсивной терапии для лечения пациентов с повреждением ЦНС. В настоящее время в мире по данным исследовательской группы профессора Pelosi среди пациентов ОИТ не менее 20% находится на ИВЛ по неврологическим показаниям [1]. Пациенты неврологических и нейрохирургических клиник, нуждающиеся в ИВЛ, имеют важное отличие от пациентов ОИТ общего профиля. Показанием для проведения ИВЛ в нейро-ОИТ является не заболевание легких рестриктивного или обструктивного типа, а нарушение работы дыхательного центра вследствие прямого или опосредованного повреждения ствола мозга или нарушение нервно-мышечной проводимости, приводящее к слабости дыхательной мускулатуры. Эта специфика показаний для ИВЛ обуславливает особенности выбора режимов ИВЛ и стратегии прекращения респираторной поддержки. В настоящей работе представлен годовой анализ использования продолжительной ИВЛ в лечении пациентов в отделении реанимации НИИ нейрохирургии им академика Н.Н. Бурденко РАМН за 2010 год.
Материалы и методы
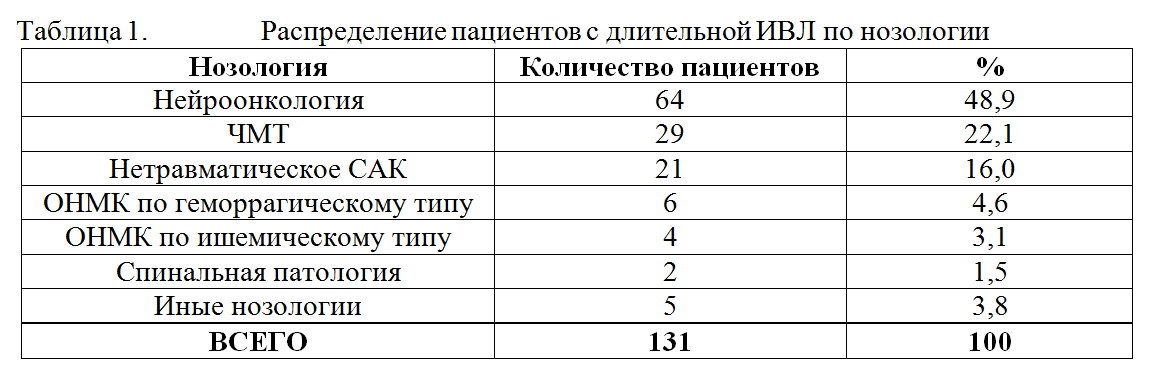
Исследование носило ретроспективный характер и было основано на анализе историй болезни пациентов, находившихся на лечении в отделении реанимации с января 2010 по декабрь 2010 г включительно. Критерием включения являлась продолжительность ИВЛ свыше 48 часов. Анализировалась длительность ИВЛ, показания к пролонгированию ИВЛ у разных категорий больных, сроки экстубации, сроки трахеостомии, частота развития вентилятор-ассоциированной пневмонии. Согласно критериям включения, для анализа была отобрана 131 история болезни. Среди включенных в исследование пациентов было 77 мужчин и 54 женщины в возрасте от 2 месяцев до 81 года (средний возраст составил 34,5±19,6 лет). Среди пациентов, потребовавших проведения пролонгированной ИВЛ, было 64 пациента с нейроонкологией, 29 пациентов с ЧМТ, 21 пациент с САК, 6 пациентов с геморрагическим инсультом, 4 пациента с ишемическим инсультом, 2 пациента со спинальной патологией и 5 пациентов с иными нозологиями. В таблице 1 представлено разделение пациентов, нуждавшихся в пролонгированной ИВЛ, по нозологии.
Методы протекции дыхательных путей
У 89 (67,9%) пациентов, получавших пролонгированную ИВЛ, была выполнена пункционная дилятационная трахеостомия. Показаниями для выполнения трахеостомии были: Ожидаемая длительная ИВЛ (>7 cуток); Грубые нарушения глотания [2]; Удаление опухоли трансоральным доступом. Всем взрослым пациентам пункционно-дилятационная трахеостомия (ПДТ) выполнялась по модификации, разработанной в Институте [3,4,5]. Во всех сложных случаях (короткая, толстая шея, положение без валика под плечами или иное нарушение анатомических ориентиров) на этапе пункции трахеи выполняется фиброскопический контроль.
Методика ухода за дыхательными путями
Уход за трахеостомой. Кожа вокруг трахеостомы обрабатывалась раствором «Октенисепт», затем на область вокруг стомы накладывалась мазь «Бетадин» на основе повидон-йода и стерильные салфетки. Перевязки выполнялись 2 раза в сутки, а в случае пропитывания салфеток отделяемым из стомы - чаще. Использовался условный критерий «вокруг трахеостомы всегда чистая, сухая салфетка». Санация носовых ходов выполнялась минимум 3-4 раза в сутки с использованием тонкого мягкого санационного катетера. После санации в носовые ходы впрыскивалась аэрозоль «Биопарокс». При обильном отделении слизи из носовых ходов, аспирация слизи производилась чаще, дополнительно использовались препараты на основе ксилометазолина («Нафтизин», «Галазолин»). В 9 случаях, при выявлении синуситов выполнялись лечебные пункции гайморовых пазух с отмыванием содержимого раствором «мирамистин» и последующим введением антибиотиков.
Санация ротоглотки
Полость рта и зубы обрабатывались с использованием раствора и аэрозоля «Гексорал» два раза в сутки или чаще. Для механического удаления густой слизи и налётов использовались палочки с ватными тампонами на конце. Часть трахеостомированных пациентов на ИВЛ получала пероральное кормление. В этом случае рот обрабатывали после каждого кормления, начиная с полоскания рта чистой водой. Для ротоглотки использовались гибкие мягкие санационные катетеры и твердые пластиковые изогнутой формы. Санация трахеи выполнялась с использованием гибких одноразовых стерильных катетеров. После однократного использования катетер выбрасывался. При наличии избыточного количества мокроты гнойного характера при санации использовался 0,1% раствор диоксидина, ex-temporo приготовленный на физиологическом растворе. При санационных фибробронхоскопиях использовался такой же раствор. У всех трахеостомированных пациентов были использованы трахеостомические трубки с каналом для санации надманжеточного пространства и особо мягкой герметизирующей манжетой – трубки фирмы «Portex» серии «Blue line Ultra Soft Seal». Использование таких трубок позволяло эффективно удалять из трахеи секрет, скапливающийся выше герметизирующей манжеты, и промывать верхние отделы трахеи и гортань.
Методика проведения ИВЛ
Искусственная вентиляция легких проводилась с использованием аппаратов Puritan Bennet 7200, Hamilton G5, Hamilton Raphael, Puritan Bennet 840. В качестве стартовых режимов ИВЛ мы использовали режимы SIMV, управляемые по объему или по давлению (272 пациента), режим ASV (33 пациента) и режим DuoPAP (10 пациентов).
В качестве стартового режима SIMV использовался в 272 случаях. Дыхательный объем составлял 8-10мл/кг. Исходная частота дыханий составляла 10-12 в мин. Поддержка давлением составляла 12-16 мбар. При появлении самостоятельных дыхательных попыток частота дыхания аппаратных вдохов уменьшалась, а уровень поддержки давлением подбирался с целью обеспечения нормовентиляции (минутный объем 100 мл/кг/мин, РаCO2 35-40 мм рт.ст.). При развитии бради- или тахипноэ наращивалась частота принудительных вдохов. Отлучение пациентов от респиратора проводилось либо путем постепенного уменьшения числа принудительных вдохов в режиме SIMV, либо путем перевода в режим Pressure Support с постепенным снижением уровня поддержки давлением, либо путем перевода в режим ASV.
Режим ASV использовался в качестве стартового у 33 пациентов. Исходный процент замещения минутного объема составлял 100% и в дальнейшем корригировался под контролем PaCO2. В большинстве случаев режим ASV хорошо переносился пациентами, и вентиляция в этом режиме осуществлялась в течение всего периода респираторной поддержки вплоть до отключения от респиратора. В ряде случаев, ввиду развития выраженной гипервентиляции при осуществлении ИВЛ в режиме ASV, приходилось переходить на другие режимы.
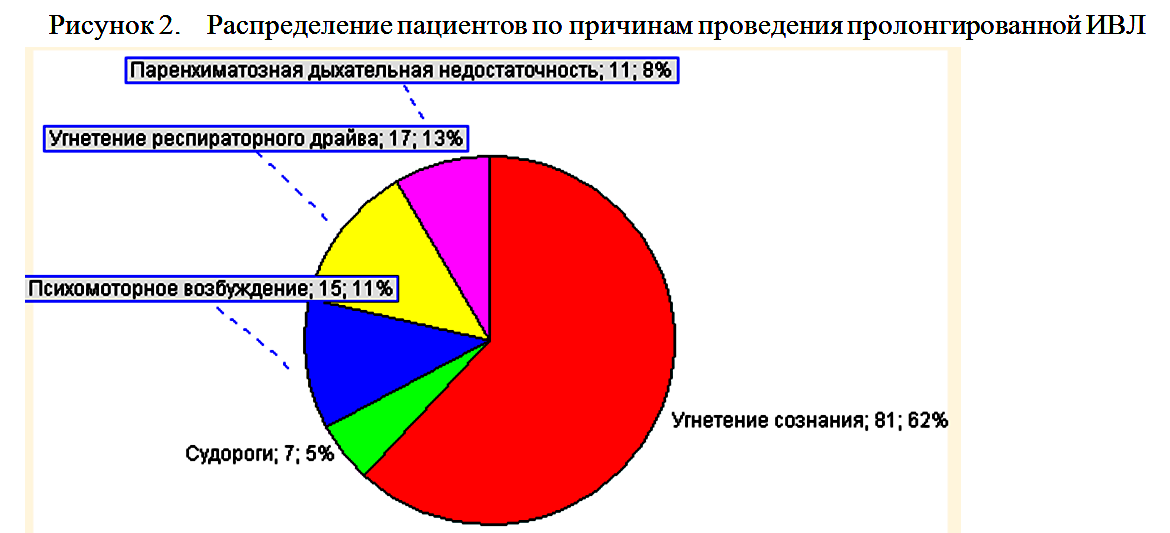
Режим DuoPAP использовался у 10 пациентов, у которых течение основного заболевания осложнялось развитием острого повреждения легких или острого респираторного дистресс синдрома. В этих случаях во избежание баро- и ателектотравмы легких с использованием построения квазистатической петли давление-объем (инструмент PV-tool на аппаратах Hamilton G5) определялись нижняя и верхняя точка перегиба. В дальнейшем ИВЛ осуществлялась в режиме DuoPAP с выставлением нижнего давления на уровне на 2 мбар выше нижней точки перегиба, а верхнего уровня давления на уровне на 2 мбар ниже верхней точки перегиба (рисунок 3).
Методика увлажнения дыхательных путей
У всех пациентов, находившихся на ИВЛ более суток, для увлажнения дыхательной смеси использовались увлажнители – обогреватели Fisher&Pyker, где в дополнение к емкости испарителя в шлангах проложен нагревающий провод. Благодаря системе автоматического поддержания температуры, получающей информацию из трех точек дыхательного контура, удаётся добиться оптимального увлажнения и согревания дыхательной смеси и избежать выпадения конденсата в дыхательном контуре. Для оценки качества увлажнения использовалась шкала оценки вязкости бронхиального секрета [9]. Жидкий – после аспирации мокроты санационный катетер чист. Умеренно вязкий – после аспирации мокроты санационный катетер сразу очищается при промывании водой. Вязкий – после аспирации мокроты санационный катетер трудно отмыть от мокроты. Во всех наблюдениях консистенция мокроты у пациентов на ИВЛ была жидкой. При анализе данных использовались методы описательной статистики. Данные представлены, как среднее ± стандартное отклонение.
Результаты и обсуждение
Средняя длительность ИВЛ составила 20,8±24,5 суток. На рисунке 1 и в таблице 2 представлено распределение пациентов по длительности ИВЛ.
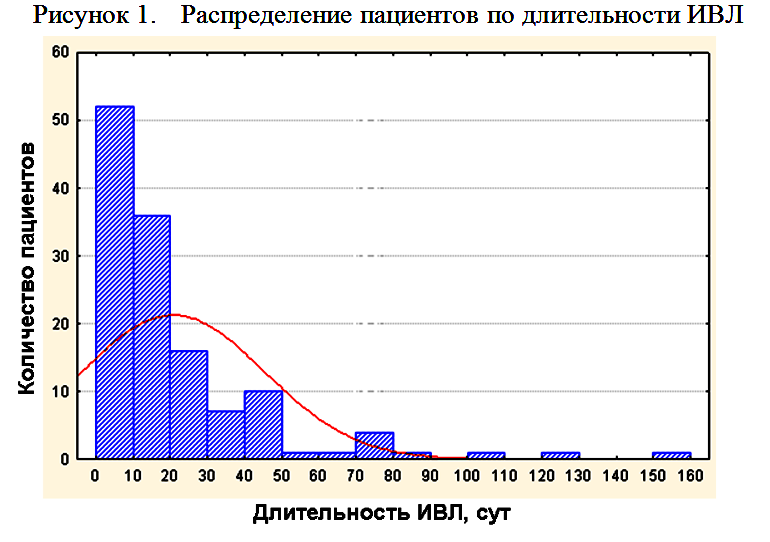

Причинами проведения пролонгированной ИВЛ служило угнетение сознания в 81 (61,8%) случаев, необходимость седации в 21 (16,8%) случаев (из них в 7 (5,3%) случаях в связи с судорогами, в 15(11,5%) случаях в связи с психо-моторным возбуждением), угнетение респираторного драйва в 17 (13%) случаев, паренхиматозная дыхательная недостаточность в 11 (8,4%) случаев (рисунок 2).
Особенности ИВЛ при различной нейрохирургической патологии
Особенности ИВЛ при ЧМТ
Средняя длительность ИВЛ у пациентов с ЧМТ составила 21,4±24 суток. В группе пациентов с ЧМТ наиболее частой причиной проведения ИВЛ было угнетение сознания (25 из 29 пациентов, 86,2%). У остальных 4 пациентов ИВЛ была пролонгирована в связи с необходимостью седации. ИВЛ при ЧМТ проводилась при уровне сознания 9 баллов по ШКГ и ниже. Обязательными компонентами мультимодального мониторинга у пациентов с ЧМТ, находящихся в коматозном состоянии, являлись мониторинг внутричерепного давления и капнография. Минутный объем вентиляции подбирался с целью достижения умеренной гипервентиляции (PaCO2 32-35 mmHg). В ряде случаев (11 пациентов), при устойчивой внутричерепной гипертензии минутный объем вентиляции увеличивался до достижения глубокой гипервентиляции (PaCO2=28-30 mmHg). Фракция кислорода во вдыхаемой смеси подбиралась под контролем газового состава артериальной крови для поддержания PaO2 90-100 мм рт.ст. Средняя FiO2 в остром периоде ЧМТ составляла 34,8±10,8 %. У пациентов с ЧМТ чаще чем у пациентов с другой нозологией отмечалось развитие ОПЛ и ОРДС. Диагноз ОПЛ выставлялся при наличии двусторонней инфильтрации легких на рентгенограмме и снижении индекса PO2/FiO2<300. Диагноз ОРДС выставлялся при наличии двусторонней инфильтрации легких на рентгенограмме и снижении индекса PO2/FiO2 менее 200. Согласно этим критериям диагноз ОРДС был выставлен у 4 пациентов с ЧМТ, диагноз ОПЛ у 12 пациентов с ЧМТ. При развитии ОРДС или ОПЛ с целью проведения расширенного респираторного мониторинга и оптимизации ИВЛ пациенты переводились на ИВЛ аппаратом Hamilton G5 в режиме DuoPAP. Для выбора оптимальных уровней нижнего и верхнего значений PEEP выполнялось построение квазистатической кривой давление-объем с использованием приема PV-tool. Суть маневра заключается в последовательном построении инспираторной и экспираторной кривой давление-объем. Маневр состоит из следующих фаз: Продленный выдох. Фаза выдоха продлевается до снижения давления до заданного Pstart. Линейное повышение давления. Давление в дыхательных путях постепенно повышается с постоянной скоростью Ramp speed до уровня Ptop. При этом фикисируется достигнутый объем. Пауза. Давление в дыхательных путях поддерживается на уровне Ptop в течение времени Tpause. Линейное снижение давления. Давление с постоянной скоростью Ramp снижается до уровня End PEEP. Установка нового PEEP. Аппарат предлагает установить новый уровень PEEP равный End PEEP.
При построении квазистатической кривой давление-объем для определения верхней и нижней точек перегиба и гистерезиса мы устанавливали Pstart=0 мбар, Ptop=60 мбар, Tpause=5 сек, PEEPend=10 мбар. На полученной квазистатической кривой давление- объем мы определяли нижнюю и верхнюю точки перегиба и гистерезис т.е. разницу объемов на экспираторной и инспираторной кривых при давлении, соответствующем нижней точке перегиба (рисунок 3).
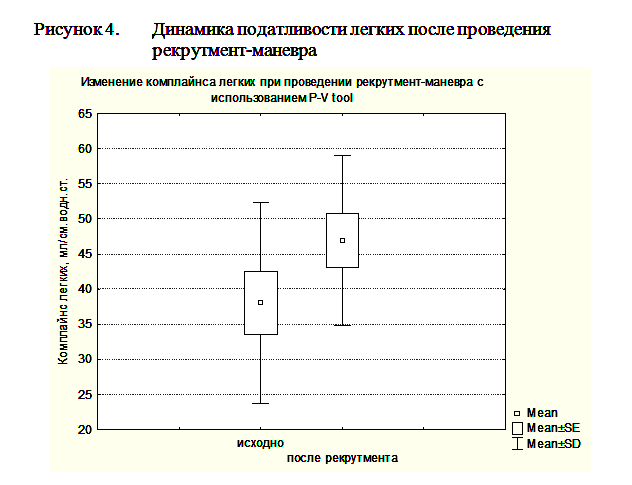
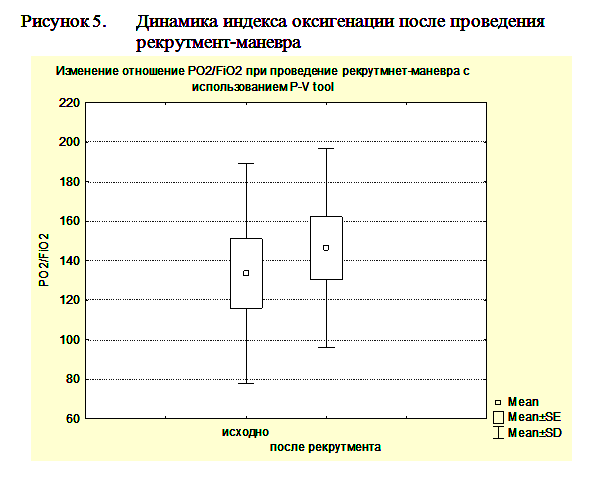
Гистерезис более 300мл мы расценивали, как предиктор эффективности рекрутмент-маневра. Рекрутмент-маневр в этих случаях выполнялся с помощью повторного маневра PVtool. При этом мы увеличивали PEEPend до значения на 2 мбар выше нижней точки перегиба, Tpause до 10сек, а остальные параметры оставляли без изменений. При гистерезисе менее 300мл рекрутмент-маневр не проводился. После выполнения маневра PVtool и, при необходимости, рекрутмент-маневра ИВЛ продолжали в режиме DuoPAP, устанавливая уровень PEEPlow на 2мбар выше нижней точки перегиба, а PEEPhigh на уровне на 2 мбар ниже верхней точки перегиба. Всего рекрутмент маневр был выполнен у 8 пациентов с ЧМТ. Проведение рекрутмент-маневра приводило к возрастанию индексу оксигенации (PO2/FiO2) с 128,9±47,4 по 148,2±55,5 и повышению комплайнса легких с 38,1±14,3 мл/мбар до 49,9±12,1 мл/мбар при ОРДС и ОПЛ (рисунки 4, 5).
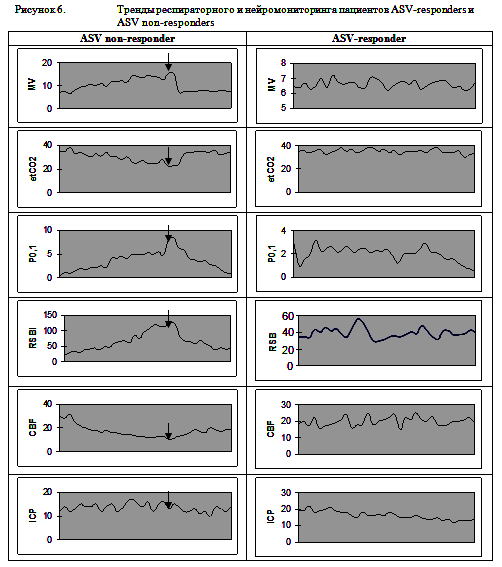
У 10 пациентов с ЧМТ мы с первых суток ИВЛ использовали режим ASV. Предположительными преимуществами режима ASV у пациентов с ЧМТ перед принудительными режимами вентиляции являются обеспечение заданного оператором минутного объема вентиляции вне зависимости от самостоятельной дыхательной активности пациента и подбор параметров вентиляции (частоты дыхания, инспираторного давления) оптимальных для защиты легких конкретного пациента, с учетом индивидуальных особенностей респираторной механики пациента. Из 10 пациентов с ЧМТ, у которых с первых суток использовался режим ASV, в 7 случаях этот режим хорошо переносился пациентами и использовался до момента отключения от респиратора. При этом отмечалось постепенное нарастание доли спонтанных вдохов и снижение подбираемого респиратором инспираторного давления. У 3 пациентов при использовании режима ASV развивалась гипервентиляция, сопровождающаяся выраженным снижением уровня PCO2 и снижением регионарного мозгового кровотока, а также нарастание уровня Р0,1. В связи с плохой переносимостью режима ASV у этих пациентов выполнялась смена режима вентиляции на SIMV. Вероятно, развитие гипервентиляции у этой группы пациентов было обусловлено ирритацией стволовых структур за счет дислокации головного мозга. Перевод в принудительные режимы вентиляции позволял добиться нормовентиляции, нормализации EtCO2 и регионарного церебрального кровотока и снижения P0,1. Примеры трендов респираторного и нейромониторинга пациентов, хорошо переносивших режим ASV (ASV-responders), и потребовавших перевода в режим SIMV (ASV non-responders) представлены на рисунке 6.
Таким образом, в большинстве случаев режим ASV хорошо переносился пациентами с черепно-мозговой травмой и позволял осуществлять респираторную поддержку с первых суток вентиляции до момента отлучения от респиратора. Использование режима ASV позволяло, во-первых, максимально сохранить спонтанную дыхательную активность без риска развития гиповентиляции, во-вторых, проводить протективную вентиляцию с непрерывной коррекцией подбираемого аппаратом инспираторного давления, минимизируя тем самым вероятность развития вентилятор индуцированного повреждения легких.
ИВЛ при нейроонкологии
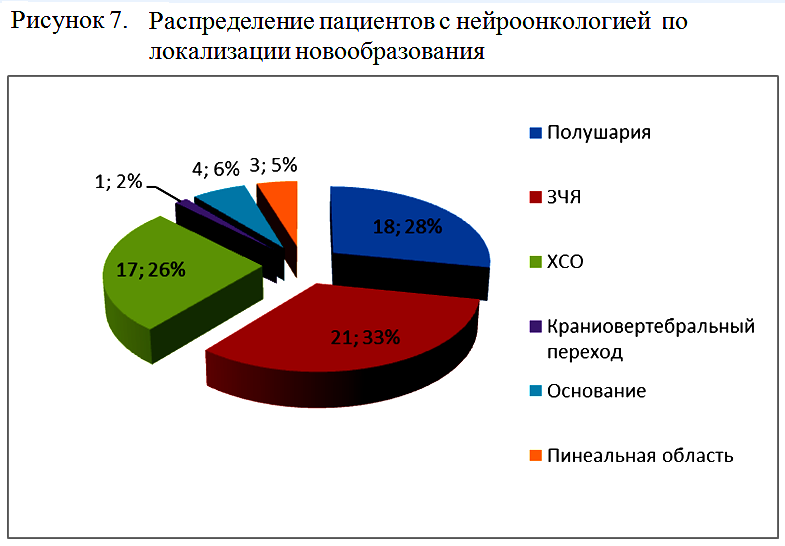
По локализации новообразования пациенты с нейроонкологией, потребовавшие проведения длительной ИВЛ, были распределены на 6 групп, как представлено на рисунке 7.
Средняя длительность ИВЛ у пациентов с нейроонкологией составила 18,4±21,3 суток. При этом отмечалась разнородность в длительности и в структуре показаний к продленной ИВЛ в зависимости от локализации новообразования.
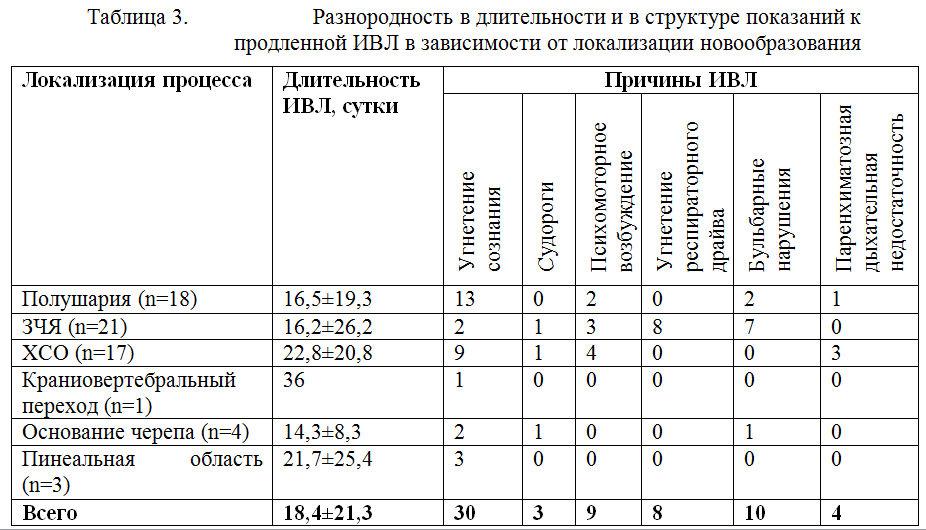
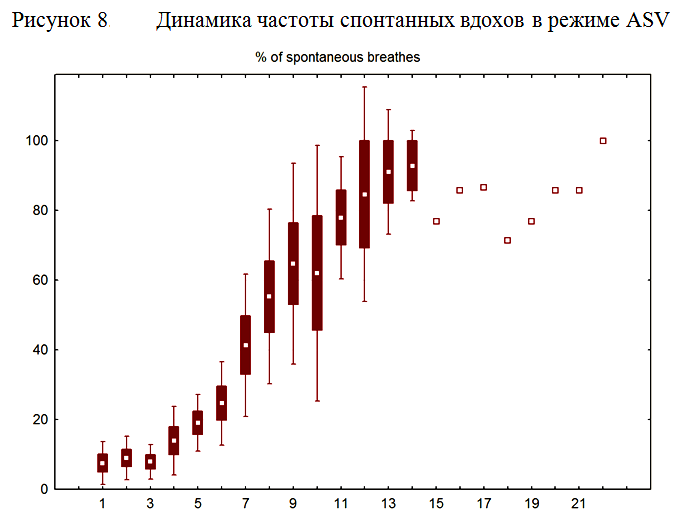
Как видно из таблицы 3, среди пациентов с локализацией процесса в полушариях основным показанием к продленной ИВЛ было угнетение сознания. Среди пациентов, оперированных на задней черепной ямке, основным показанием к пролонгированию ИВЛ служила стволовая дисфункция в виде угнетения респираторного драйва, либо в виде бульбарных нарушений. Хотя бульбарные нарушения не являются показанием к искусственной вентиляции легких, а требует исключительно защиты дыхательных путей путем их протезирования, в ряде случаев наличие грубого бульбарного синдрома служило причиной пролонгированной ИВЛ. Так у 7 пациентов, оперированных по поводу опухолей задней черепной ямки, у которых в раннем послеоперационном периоде было восстановлено ясное сознание, прошедших тест спонтанного дыхания (Spontaneous breathing trial), искусственная вентиляция легких была пролонгирована в связи с грубыми нарушениями глотания. Средняя длительность ИВЛ у этой подгруппы пациентов составила 5,3±2,6 суток. Из 7 пациентов с бульбарным синдромом 2 пациента были успешно экстубированы на 3-5 день после операции. У 5 пациентов попытка экстубации оказалась неуспешной, и для защиты дыхательных путей от аспирации была выполнена трахеостомия, после чего ИВЛ была прекращена. Поражение стволовых структур может сопровождаться развитием дыхательной недостаточности центрального генеза вследствие угнетения респираторного драйва и развития поверхностного дыхания со сниженной частотой, вплоть до апноэ. При проведении ИВЛ у данной группы пациентов является опасным преждевременное снижение степени респираторной поддержки вследствие недооценки тяжести поражения ствола головного мозга на фоне высокого уровня бодрствования и выявления критериев готовности к отлучению от респиратора. Преждевременный перевод во вспомогательные режимы ИВЛ на фоне недостаточного восстановления дыхательного драйва может приводить к нарушениям дыхания по стволовому типу, эпизодам апноэ и брадипноэ. Возникающие нарушения дыхания могут усугублять гипоксию в пораженной области ствола головного мозга и еще в большей степени усугублять стволовую дисфункцию и угнетение респираторного драйва, а это требует повторного перевода больного в принудительные режимы ИВЛ. У пациентов с угнетением респираторного драйва мы использовали режим ASV. Преимуществом режима ASV у данной категории больных является непрерывная коррекция респиратором частоты принудительных вдохов и уровня давления поддержки в зависимости от спонтанной дыхательной активности пациента, которая при поражении респираторного драйва может существенно варьировать в течение суток. Исходно спонтанная дыхательная активность у данной группы пациентов была существенно снижена, и целевой минутный объем доставлялся преимущественно за счет принудительных вдохов. В первые сутки вентиляции в режиме ASV процент спонтанных вдохов составил 9,0±6,2. На протяжении вентиляции в режиме ASV отмечалось постепенное нарастание частоты спонтанных вдохов (рисунок 8). К моменту прекращения респираторной поддержки у всех пациентов 100% вдохов были инициированы пациентом.
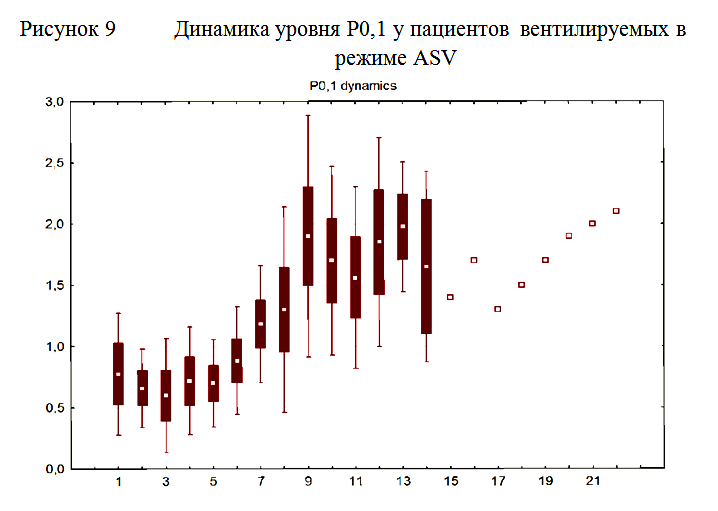
У всех пациентов исходно уровень показателя P0,1, отражающего активность дыхательного центра, был значительно ниже нормальных значений и составлял 0,78±0,5. По мере нарастания спонтанной дыхательной активности отмечалось нарастание показателя P0,1, который со временем достигал нормальных значений. К моменту прекращения ИВЛ средний уровень P0,1 составлял 2,5±0,3 (рисунок 9).
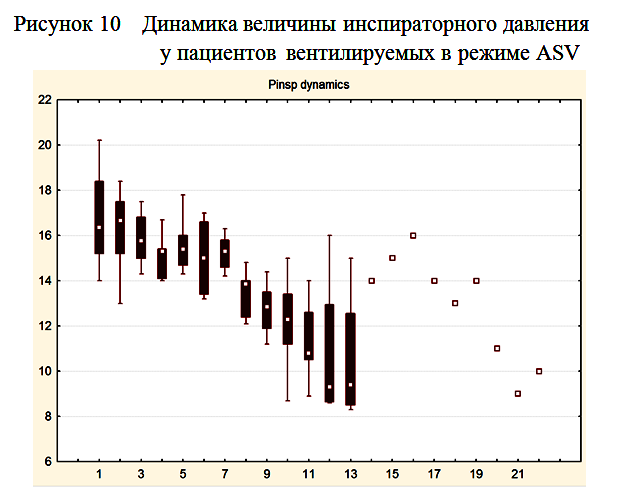
По мере нарастания спонтанной дыхательной активности отмечалось постепенное снижение инспираторного давления, подбираемого респиратором для достижения целевого дыхательного объема. К моменту прекращения респираторной поддержки инспираторное давление у всех пациентов не превышало 10 мбар (рисунок 10).
Вентилятор-ассоциированная пневмония (ВАП)
Диагноз вентилятор-ассоциированной пневмонии выставлялся при наличии инфильтративных изменений на рентгенограмме легких и наличии, как минимум, двух из четырех следующих критериев: температура тела больше 38,0ºС или меньше 36,0ºС; наличие гнойной мокроты; лейкоцитоз больше 11 тыс/мл или лейкопения менее 4 тыс/мл; PaO2/FiO2<300. При двух из четырех перечисленных критериев и отсутствии инфильтративных изменений на рентгенограмме выставлялся диагноз трахеобронхит. Общая частота развития инфекций дыхательных путей составила 41,2% (54 из 131 пациентов). Из них в соответствии с данными рентгенограммы диагноз пневмония был поставлен в 29 случаях (22,1%), а диагноз гнойный трахеобронхит в 25 случаях (19,1%). У пациентов с ЧМТ частота развития инфекций дыхательных путей была значительно выше, чем у пациентов после плановых нейрохирургических вмешательств (таблица 4).
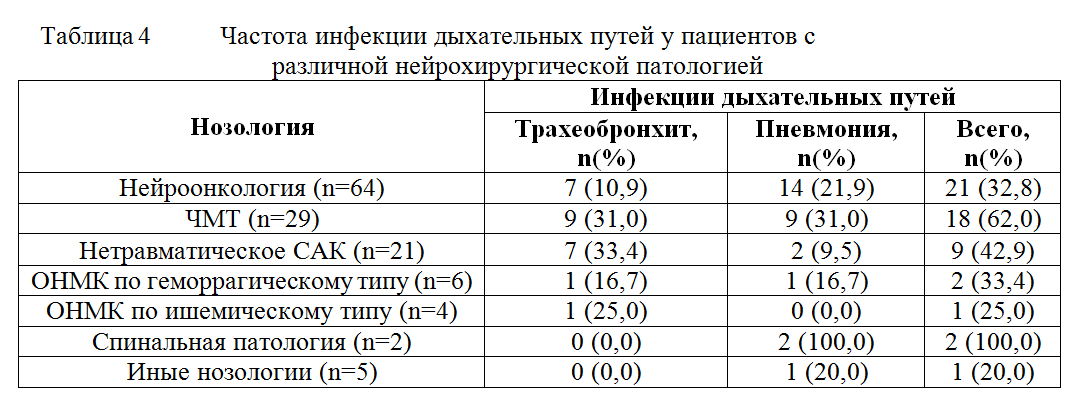
Более высокая частота развития ВАП у пациентов с ЧМТ обусловлена, по-видимому, высоким риском аспирации на догоспитальном этапе, высокой частотой развития синуситов. Развитие вентилятор ассоциированной пневмонии сопровождалось увеличением длительности нахождения на ИВЛ, в то время как развитие гнойного трахеобронхита не приводило к значимому приросту длительности ИВЛ по сравнению с пациентами без инфекции дыхательных путей. Таким образом, в ходе нашего исследования было показано, что имеется специфика респираторных проблем у различных категорий нейрохирургических пациентов. Так, у пациентов с ЧМТ чаще чем у пациентов с иной нейрохирургической патологией отмечается развитие острого повреждения легких и острого респираторного дистресс синдрома. Частое развитие ОРДС при ЧМТ может быть обусловлено несколькими факторами. Согласно концепции «двойного удара», острое повреждение мозга может приводить к повреждению легких за счет двух основных механизмов [6]. Во-первых, поврежденный мозг является источником провоспалительных цитокинов, и тригерром к развитию системного воспалительного ответа [7-10]. Было показано, что у пациентов с изолированной ЧМТ отмечается повышение таких медиаторов воспаления как IL-1, IL-6, TNF и др. В работе McKeating и соавт. сравнивалась концентрация IL-6 и в артериальной крови и в крови оттекающей от головного мозга, забранной из луковицы яремной вены [9]. Было показано, что в оттекающей от мозга крови концентрация провоспалительных цитокинов существенно превышает таковую в артериальной крови, что свидетельствует о том, что источником провоспалительных цитокинов у пациентов с ЧМТ служит именно поврежденный мозг. Развивающаяся системная воспалительная реакция приводит к повышению проницаемости легочных капилляров, миграции нейтрофилов и активированных макрофагов в альвеолярное пространство, повреждению пневмоцитов 2 типа и, как следствие, к развитию ОПЛ и ОРДС (первый удар). Вторым значимым фактором является необходимость применения агрессивной ИВЛ для обеспечения гипервентиляции для контроля внутричерепного давления. Использование для обеспечения гипервентиляции высоких дыхательных объемов способствуют развитию вентилятор-ассоциированного повреждения легких (второй удар) [11-12]. Среди пациентов с повреждением стволовых структур вследствие операций по поводу опухолей задней черепной ямки частым респираторным осложнением являлось угнетение респираторного драйва, обуславливающие трудный вининг в данной категории больных. В ходе нашего исследования было показано, что традиционные критерии готовности пациента к отлучению от респиратора, не учитывающие состояние респираторного драйва, в ряде случаев оказываются неэффективными. Нами была продемонстрирована эффективность использования показателя Р0,1 как предиктора готовности к прекращению респираторной поддержки. У пациентов с дыхательной недостаточностью, обусловленной причинами, не связанными с угнетением респираторного драйва, показатель P0,1, как правило, повышен, и степень его повышения является предиктором неэффективности отлучения от респиратора [13-15]. В нашем исследовании у пациентов с повреждением стволовых структур головного мозга наблюдается обратная закономерность и предиктором неэффективности отлучения от респиратора является снижение показателя P0,1 ниже средней нормы. Это согласуется с данными, полученными Yao-Kuang Wu и соавторами, которые показали, что у пациентов, оперированных по поводу опухолей ствола головного мозга, у которых было произведено успешное отлучение от респиратора, показатель P0,1 был значительно выше, чем у пациентов, у которых попытки прекращения респираторной поддержки оказались неэффективными, и потребовалось проведение продленной ИВЛ [16]. В этой же работе было показано, что дополнительным предиктором неэффективности отлучения от респиратора является отсутствие значимого прироста показателя P0,1 в ответ на гиперкапнию. Также было показано, что использование интеллектуального режима ASV, обеспечивающего заданный оператором минутный объем вне зависимости от самостоятельной дыхательной активности пациента с одной стороны, и максимально сохраняющего спонтанную дыхательную активность с другой стороны, позволяют сократить сроки ИВЛ у пациентов с повреждением ствола головного мозга.
Список литературы
- Pelosi P, Ferguson ND, Frutos-Vivar F, Anzueto A, Putensen C, Raymondos K, Apezteguia C, Desmery P, Hurtado J, Abroug F, Elizalde J, Tomicic V, Cakar N, Gonzalez M, Arabi Y, Moreno R, Esteban A; Ventila Study Group. Management and outcome of mechanically ventilated neurologic patients. Crit Care Med. 2011 Jun;39(6):1482-92.
- Горячев А.С., Савин И.А, Пуцилло М.В. и соавт. Нарушения глотания у больных с повреждением ствола головного мозга. Шкала оценки и терапевтическая стратегия. Журнал Вопросы нейрохирургии – 2006 – №4 – С. 27 – 32.
- Горшков К.М., Горячев А.С., Савин И.А. и соавт. // Интраоперационные и ранние осложнения пункционно-дилятационной трахеостомии у нейрохирургических больных . АИР – 2008 – № 2- С. 75-78.
- Горячев А. С., Савин И. А., Горшков К. М. и соавт. // Журнал Анестезиология-Реаниматология – 2004 – №2- С.58-61. Ранняя трахеостомия у больных с опухолями задней черепной ямки в послеоперационном периоде.
- Горячев А.С., Савин И.А., Горшков К.М. и соавт. // Осложнения пункционно-дилятационной трахеостомии у нейрохирургических больных. – Вестник интенсивной терапии. – 2009 – №2 – С.11-16
- Luciana Mascia Acute Lung Injury in Patients with Severe Brain Injury: A Double Hit Model. Neurocrit Care (2009) 11:417–426
- Lucas SM, Rothwell NJ, Gibson RM. The role of inflammation in CNS injury and disease. Br J Pharmacol. 2006;147(Suppl 1): S232–40.
- Ott L, McClain CJ, Gillespie M, Young B. Cytokines and metabolic dysfunction after severe head injury. J Neurotrauma. 1994; 11:447–72.
- McKeating EG, Andrews PJ, Signorini DF, Mascia L. Transcranial cytokine gradients in patients requiring intensive care after acute brain injury. Br J Anaesth. 1997;78:520–3.
- Hutchinson PJ, O’Connell MT, Rothwell NJ, et al. Inflammation in human brain injury: intracerebral concentrations of IL-1alpha, IL-1beta, and their endogenous inhibitor IL-1ra. J Neurotrauma. 2007;24(10):1545–57. 11 Ranieri VM, Suter PM, Tortorella C, et al. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome. A randomised controlled trial. JAMA. 1999;282:54–61.
- Tremblay L, Valenza F, Ribeiro SP, Li J, Slutsky AS. Injurious ventilatory strategies increase cytokines and c-fos m-RNA expression in an isolated rat lung model. J Clin Invest. 1997; 99(5):944–52.
- Okamoto K, Sato T, Morioka T. Airway occlusion pressure (P0.1)-a useful predictor for the weaning outcome in patients with acute respiratory failure.// J Anesth. 1990; №4(suppl 2): p95-101.
- Vargas F, Boyer A, Bui HN et al. Respiratory failure in chronic obstructive pulmonary disease after extubation: value of expiratory flow limitation and airway occlusion pressure after 0.1 second (P0.1).// J Crit Care. 2008; №23(suppl 4): p577-84.
- Fernandez R, Raurich JM, Mut T et al. Extubation failure: diagnostic value of occlusion pressure (P0.1) and P0.1-derived parameters. //Intensive Care Med. 2004; №30 (suppl2): p234-40.
- Yao-Kuang Wu, Chih-Hsin Lee, Ben-Chang Shia et al. Response to hypercapnic challenge is associated with successful weaning from prolonged mechanical ventilation due to brain stem lesions.// Intensive Care Med. 2009; №35: p108–114






