Полупан А.А., Горячев А.С., Савин И.А., Сатишур О.Е., Ошоров А.В., Попугаев К.А., Сычев А.А., Табасаранский Т.Ф., Крылов К.Ю., Соколова Е.Ю., Мезенцева О.Ю., Подлепич В.В., Непомнящий В.П. НИИ нейрохирургии им.акад.Н.Н.Бурденко РАМН, Москва, *Больница скорой медицинской помощи, Минск, * НИИ скорой помощи им. Н.В. Склифосовского, Москва
Введение
Р0.1– величина снижения давления в дыхательных путях в первые 100 мсек самостоятельной дыхательной попытки пациента при окклюзии дыхательного контура [4]. Этот показатель в норме у здорового человека составляет от -2 мбар до -4 мбар или -2/-4 см водного столба. У пациентов с обструктивыми или рестриктивными заболеваниями легких этот показатель выше нормы. Больному трудно вдохнуть и он вынужден прикладывать дополнительные усилия, чтобы преодолеть повышенное сопротивление дыхательных путей (при ХОБЛ) или жестких (stiff) легких (при пневмонии). Таким образом повышение Р0.1 является критерием увеличения работы дыхания пациента [8,9,10]. Современные аппараты ИВЛ оснащены системами для измерения Р0.1. В начале каждого спонтанного вдоха пациента аппарат постоянно производит измерение Р0.1 и выводит показатель на экран монитора. Если врачу удается подобрать оптимальный уровень поддержки вдохов, Р0.1 приближается к норме. Работа дыхания пациента снижается, комфортность ИВЛ увеличивается [11,12,13]. Р0.1 рутинно используется при паренхиматозной дыхательной недостаточности для оценки работы дыхания пациента и для подбора оптимального давления респираторной поддержки. Для пациентов нейрохирургической клиники после плановых операций более характерно развитие не паренхиматозной, а вентиляционной дыхательной недостаточности, когда дыхательная мускулатура не обеспечивает вдохов достаточной глубины и частоты. Иначе говоря, происходит угнетение дыхания. При интракраниальных вмешательствах к угнетению ЦНС или непосредственному повреждению ствола мозга приводят факторы хирургической агрессии (тракции мозга, электрокоагуляция, нарушение васкуляризации и т.д.) или послеоперационные осложнения (гематомы, отек мозга, дислокации, пневмоцефалия). Вариант вентиляционной дыхательной недостаточности, при котором нарушается функция дыхательного центра, описывают как нарушение респираторного драйва. Респираторный драйв – это способность дыхательного центра инициировать вдохи адекватные по частоте, глубине и ритму в соответствии с функциональной задачей. У пациентов, оперированных по поводу опухолей задней черепной ямки, необходимость в продлении ИВЛ возникает чаще, чем после удаления опухолей других локализаций. По данным Cata и соавт., 18% пациентов после операций на структурах ЗЧЯ требуют продленной ИВЛ в раннем послеоперационном периоде [1]. Анализ причин продленной ИВЛ у пациентов с осложненным течением послеоперационного периода выявил, что имеются различия в структуре показаний к пролонгированию ИВЛ при различной локализации процесса. Так, наиболее частой причиной продолжения ИВЛ у пациентов после инфратенториальных вмешательств служили бульбарные нарушения и угнетение дыхания на фоне поражения дыхательного центра, в то время как после супратенториальных вмешательств основными показаниями к проведению продленной ИВЛ служили глубокое угнетение сознания или необходимость седации в связи с судорогами или психомоторным возбуждением [2]. Поражение дыхательного центра клинически проявляется нарушением дыхания в виде апноэ или брадипноэ, а также в виде снижения силы дыхательных попыток пациента. У таких пациентов величина Р0.1 ниже нормы. Традиционные критерии готовности к отлучению от респиратора, такие как показатель «частого поверхностного дыхания», или индекс Тобина, или максимальное усилие вдоха, не учитывают состояние респираторного драйва, в связи с чем у пациентов с поражением ствола головного мозга они часто оказываются неэффективными [3]. Дополнительный риск для пациентов с поврежденным стволом мозга создает повышенная утомляемость дыхательного центра. Вследствие утомления после периода вполне адекватного дыхания может возникнуть брадипноэ со снижением дыхательного объема (редкое поверхностное дыхание). Из используемых в настоящее время критериев, характеризующих респираторный драйв наиболее доступным для прикроватного измерения является показатель Р0.1. Логично ожидать, что у пациентов с угнетением или повреждением дыхательного центра Р0.1 будет снижен, однако публикаций по этой прблеме мало. При проведении поиска литературы в PubMed мы нашли только одну работу, посвященную оценке показателя Р0.1, у пациентов с повреждением ствола головного мозга и поражением дыхательного центра [7].
Цель работы
Оценить эффективность показателя P0.1 как предиктора успешного прекращения ИВЛ у пациентов после удаления опухолей ЗЧЯ
Материалы и методы
В исследование было включено 25 пациентов после удаления опухолей ЗЧЯ. Пациенты были разделены на две группы в зависимости от успешности экстубации. В группу 1 вошли 15 пациентов, которые были успешно экстубированы в первые 24 часа после операции. В группу 2 вошли 10 пациентов, которым потребовалось проведение пролонгированной ИВЛ в связи с недостаточной дыхательной активностью, проявляющейся эпизодами апноэ, брадипноэ или недостаточной глубиной дыхания при переводе на спонтанное дыхание. Характеристика исследуемых пациентов представлена в таблице №1.
Пациенты, которым пролонгированная ИВЛ осуществлялась в связи с интракраниальными (внутричерепная гематома, пневмоцефалия, нарушение ликвородинамики) или соматическими осложнениями (паренхиматозная дыхательная недостаточность, гемодинамическая нестабильность) в исследование не включались. У всех пациентов, включенных в исследование, ИВЛ проводилась с использованием респиратора Hamilton G5 в режиме ASV. Показатель P0.1 измерялся респиратором для каждого спонтанного вдоха. Во всех наблюдениях производился мониторинг частоты дыхания, дыхательного объема, индекса частого поверхностного дыхания, сатурации артериальной крови кислородом и EtCO2. После пробуждения выполнялся тест спонтанного дыхания (Spontaneous breathing trial - SBT). Для этого мы переключали респиратор в спонтанный режим вентиляции, продолжая мониторировать показатели P0.1, частоты дыхания, дыхательного объема, индекса частого поверхностного дыхания, сатурации артериальной крови кислородом и EtCO2. Тест спонтанного дыхания производился в течение 60 минут. Критериями для преждевременного прекращения теста спонтанного дыхания служили снижение частоты дыхания менее 6 в мин, снижение дыхательного объема менее 200 мл, снижение сатурации менее 92% или возрастание EtCO2 более 45 мм.рт.ст. Пациенты, которые успешно прошли тест спонтанного дыхания были экстубированы.
Результаты исследования и их обсуждение
Анализируя результаты исследования мы отвечаем на четыре вопроса: Какие значения Р0,1 наблюдалось в группе с успешной экстубацией (1) и группе с продленной ИВЛ (2) во время SBT. Как менялась величина Р0,1 во время SBT в группах с успешной экстубацией и с продленной ИВЛ. Оценить абсолютный показатель величины Р0,1 во время SBT как самостоятельный предиктор успешности прекращения ИВЛ у пациентов с поврежденным стволом мозга. Оценить значение прироста Р0,1 (ΔР0.1) во время SBT как предиктор успешности прекращения ИВЛ у пациентов с поврежденным стволом мозга.
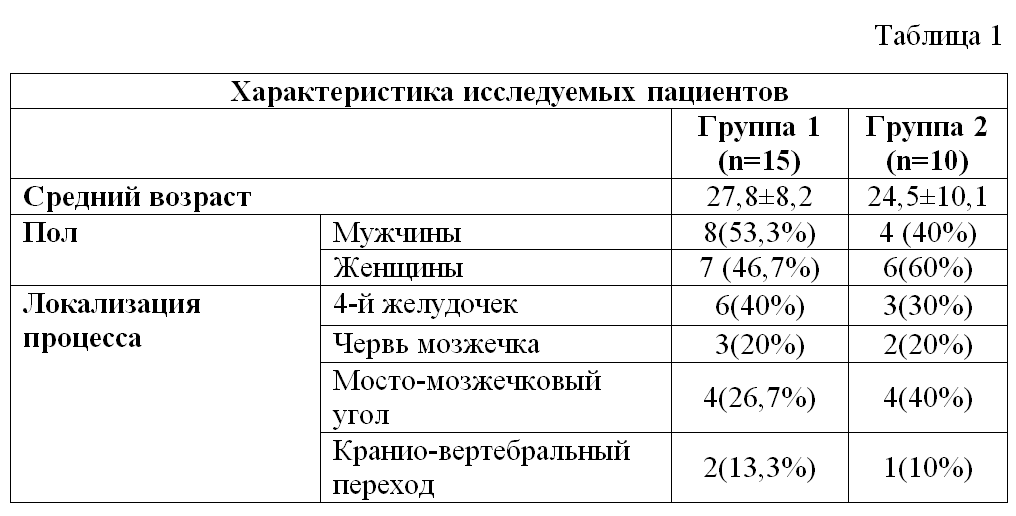
1: Величина Р0,1 во время SBT в группах с успешной экстубацией и с продленной ИВЛ. Средний уровень показателя Р0,1 в группе 1 (успешная экстубация) составил 4,4±1,2 и был статистически значимо выше, чем в группе 2 (продленная ИВЛ) - 1,2±0,6 (Р<0,05) (Рисунок 1).
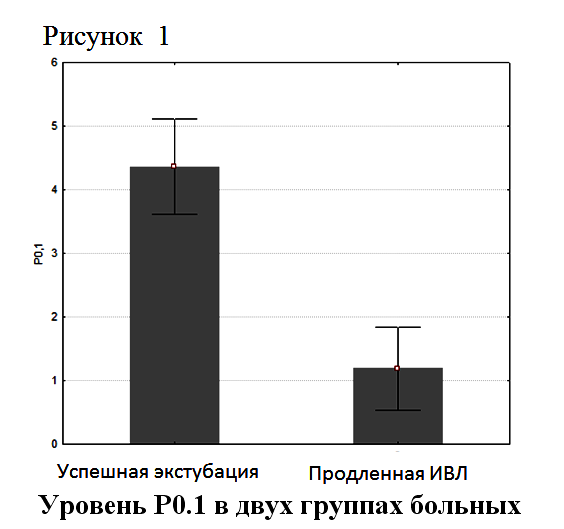
2: Изменение величины Р0,1 во время SBT в группах с успешной экстубацией и с продленной ИВЛ. В ходе исследования нами отмечен феномен нарастания значения Р0,1 во время выполнения теста спонтанного дыхания. Динамика Р0,1 оценивается нами как адаптация пациента к спонтанному дыханию. Мы называем этот динамический показатель «прирост Р0,1» или ΔР0.1. В группе 1 при проведении теста спонтанного дыхание отмечался статистически значимый прирост показателя Р0,1 с 4,4±2,2 до 6,9±3,4 (р<0,05). У пациентов группы 2 средний уровень показателя Р0.1 к моменту завершения теста спонтанного дыхания составил 1,4±0,9, что значимо не отличалось от исходного уровня (Р>0,1) (Рисунок 2).
3: Средняя продолжительность ИВЛ у пациентов группы 2 составила 13,8±4,8 суток. На всем протяжении респираторной поддержки у этих пациентов мы использовали режим ASV. При этом по мере нарастания спонтанной дыхательной активности отмечалось постепенное нарастание уровня P0.1, который к моменту прекращения ИВЛ составил 3,2±1,9. Средний прирост P0,1 при проведении теста спонтанного дыхания, выполненного в первые послеоперационные сутки после пробуждения больного, составил 2,3±1,7 в группе 1 и 0,3±0,3 в группе 2 (P<0,01).
Величина Р0,1 во время SBT как самостоятельный предиктор успешности прекращения ИВЛ у пациентов с поврежденным стволом мозга. Приводим анализ взаимосвязи успешности экстубации и показателя Р0.1 после пробуждения при проведении теста спонтанного дыхания. Для оценки абсолютной величины Р0.1, как предиктора успешного прекращения ИВЛ, мы разделили всех пациентов включенных в исследование в соответствии с величиной Р0.1 полученной во время SBT. Точкой раздела взяли Р0.1=2 мбар. Из всех пациентов включенных в исследование у 16 пациентов было Р0.1>2 (нормальный), а у 9 пациентов было Р0.1<2 (низкий). Из 16 пациентов с нормальным Р0.1(>2) 14 были успешно экстубированы, а 2 протребовали проведения продленной ИВЛ. Среди пациентов с низким Р0.1 (<2) только 1 пациент был экстубирован и переведен на самостоятельное дыхание в течение первых 24 часов, а остальные 8 потребовали продленной ИВЛ (Таблица №2).

Таким образом, чувствительность критерия P0,1>2, как предиктора успешной экстубации составила 14/15100%=93,3%, а специфичность 14/16100%=87,5%.
4: Прирост Р0,1 (ΔР0.1) во время SBT как предиктор успешности прекращения ИВЛ у пациентов с поврежденным стволом мозга. Для оценки прогностической значимости величины прироста Р0.1 (ΔР0.1) в ходе теста спонтанного дыхания пациенты были разделены в зависимости от величины ΔР0.1. Исходя из предварительной оценки результатов исследования величиной прироста Р0.1 для разделения выбрали ΔР0.1= 1мбар. В результате у 12 человек была ΔР0.1>1, а у 13 человек прирост Р0.1 во время SBT, меньше 1мбар (ΔР0.1<1). Все 12 пациентов с хорошим нарастанием Р0.1 во время SBT (ΔP0.1>1) были успешно экстубированы. Из 13 пациентов с ΔР0.1<1 только 3 были успешно экстубированы, а остальные 10 потребовали продленной ИВЛ (Таблица №3).

Таким образом, чувствительность критерия ΔP0.1>1, как предиктора успешной экстубации составила 12/12100%=100%, а специфичность 12/15100%=80%. У пациентов с дыхательной недостаточностью, обусловленной причинами, не связанными с угнетением респираторного драйва, показатель P0,1, как правило, повышен, и степень его повышения является предиктором неэффективности отлучения от респиратора. Уставлено, что у пациентов с дыхательной недостаточностью, обусловленной первично-легочной патологией, при недостаточной респираторной поддержке отмечается рост показателя Р0.1, что отражает повышение респираторного драйва и работы дыхания и является предиктором невозможности прекращения респираторной поддержки и экстубации [5,6]. В нашем исследовании у пациентов с повреждением стволовых структур головного мозга наблюдается обратная закономерность и предиктором неэффективности отлучения от респиратора является снижение показателя P0,1 ниже средней нормы. Это согласуется с данными Yao-Kuang Wu и соавт., установившими, что после операций по поводу опухолей ствола головного мозга, у пациентов успешно переведенных на самостоятельное дыхание показатель P0,1 был значительно выше, чем у пациентов, нуждавшихся в продленной ИВЛ. В этой же работе было показано, что дополнительным предиктором неэффективности отлучения от респиратора является отсутствие значимого прироста показателя P0,1 в ответ на гиперкапнию [7]. Важно отметить, что в работе, оценивающей прирост показателя P0,1 в ходе SBT у пациентов с первично-легочной патологией, пациенты успешно переведенные на спонтанное дыхание продемонстрировали в ходе SBT достоверно более низкую ΔР0.1 чем пациенты неспособные к самостоятельному дыханию [14].
В ходе нашего исследования было показано, что у пациентов после операций по поводу опухолей ЗЧЯ анализ показателя Р0,1 при проведении теста спонтанного дыхания может быть использован как предиктор успешной экстубации. В 8 наблюдениях из 9 с абсолютной величиной Р0.1<2 экстубация была невозможна. При абсолютной величине Р0.1>2 в 14 наблюдениях из 16 было выполнено успешное прекращение ИВЛ в первые 24 часа после операции. Поскольку в ходе теста спонтанного дыхания изменялась величина Р0.1, нами был использован динамический показатель: прирост Р0.1, или ΔР0.1. Для пациентов с воздействием на структуры ствола головного мозга нами получен обратный результат: пациенты имевшие минимальную ΔР0.1 оказались не готовы к переводу на самостоятельное дыхание и прекращение ИВЛ. Мы полагаем, что ΔР0.1 отражает способность дыхательного центра отвечать на изменяющиеся потребности пациента в вентиляции. Если у пациентов с легочной патологией и сохранным дыхательным центром ΔР0.1 отражает состояние дыхательной системы, то у пациентов с поврежденным дыхательным центром и сохранными легкими ΔР0.1 в ходе SBT отражает степень повреждения ствола мозга и дыхательного центра.
Выводы
- У пациентов с повреждением ствола мозга отмечено снижение Р0.1 ниже среднестатистической нормы.
- У пациентов с повреждением ствола мозга в данном исследовании низкий Р0.1 (1,2±0,6) коррелирует с необходимостью в продленной ИВЛ и невозможностью перехода на самостоятельное дыхание.
- В данном исследовании Р0.1>2, коррелирует с успешным прекращением ИВЛ и переходом на самостоятельное дыхание.
- У пациентов включенных в исследование в ходе SBT было отмечено нарастание величины Р0.1.
- Степень нарастания Р0.1 или ΔР0.1 в ходе SBT коррелирует с успешностью прекращения ИВЛ. ΔP0.1>1 предиктор успешного прекращения ИВЛ, а ΔР0.1<1 предиктор необходимости продолжения ИВЛ.
Литература
- Cata J.P., Saager L., Kurz A., et al. Successful extubation in the operating room after infratentorial craniotomy: the Cleveland Clinic experience.// J. Neurosurg. Anesthesiol. 2011. V.23(suppl 1). p.25-29.
- Полупан А.А., Попугаев К.А., Ошоров А.В. и др. Длительная ИВЛ в отделении нейрореанимации. Анализ результатов за 2009 год.// Анест. и реан. 2010. №4, стр. 63-69.
- Ko R., Ramos L., Chalela J.A. Conventional weaning parameters do not predict extubation failure in neurocritical care patients.// Neurocrit Care. 2009 V.10(suppl 3). p.269-273.
- Montgomery A.B., Holle R.H., Neagley S.R., et al. Prediction of successful ventilator weaning using airway occlusion pressure and hypercapnic challenge.// Chest. 1987. V.91. p.496–499.
- Vargas F., Boyer A., Bui H.N., et al. Respiratory failure in chronic obstructive pulmonary disease after extubation: value of expiratory flow limitation and airway occlusion pressure after 0.1 second (P0.1).// J Crit Care. 2008. V.23.(suppl 4). p.577-584.
- Hilbert G., Gruson D., Portel L., et al. Airway occlusion pressure at 0.1 s (P0.1) after extubation: an early indicator of postextubation hypercapnic respiratory insufficiency. Intensive Care Med.1998. V. 24. p.1277-1282.
- Yao-Kuang Wu, Chih-Hsin Lee, Ben-Chang Shia, et al. Response to hypercapnic challenge is associated with successful weaning from prolonged mechanical ventilation due to brain stem lesions.// Intensive Care Med. 2009. V35. p.108–114
- Okamoto K, Sato T, Morioka T. Airway occlusion pressure (P0.1)-a useful predictor for the weaning outcome in patients with acute respiratory failure.// J. Anesth. 1990. V.4(suppl 2). p.95-101.
- Vargas F., Boyer A., Bui H.N., et al. Respiratory failure in chronic obstructive pulmonary disease after extubation: value of expiratory flow limitation and airway occlusion pressure after 0.1 second (P0.1).// J. Crit. Care. 2008. V.23(suppl 4). p.577-584.
- Fernandez R., Raurich J.M., Mut T., et al. Extubation failure: diagnostic value of occlusion pressure (P0.1) and P0.1-derived parameters. //Intensive Care Med. 2004. V.30 (suppl2). p.234-240.
- Perrigault P.F., Pouzeratte Y.H., Jaber S., et al. Changes in occlusion pressure (P0.1) and breathing pattern during pressure support ventilation.// Thorax. 1999. V.54(suppl2). p.119-123.
- Iotti G., Braschi A., Galbusera C. P0.1, breathing pattern and pressure support ventilation.// Intensive Care Med. 1996. V.22(suppl 10). p.1131-1132.
- Неверин В.К., Марченков Ю.В. Окклюзионное давление в первые 100 мс вдоха (Р0.1) как показатель возможности снижения дыхательной поддержки при острой дыхательной недостаточности.// Анест. и реан. 1997. N4, стр. 40 - 45.
- Bellani G., Foti G., Spagnolli E., et al. Increase of oxygen consumption during a progressive decrease of ventilatory support is lower in patients failing the trial in comparison with those who succeed.// Anesthesiology. 2010. V.113 (suppl 2). p.378-385.






