НИИ Нейрохирургии Бурденко, РАМН, Москва
Введение
Артериальная гипотензия (АГ) развивается у 68% пациентов с опухолями хиазмально-селлярной области (ХСО) при осложненном течении послеоперационного периода [1, 2]. Обычно она связана со снижением периферического сосудистого сопротивления и относительной гиповолемией. У трети пациентов развивается снижение сердечного выброса (СВ) вследствие брадикардии на фоне декомпенсированного гипотиреоза [14]. Исходя из этого, основными направлениями в коррекции АГ стало использование альфа-симпатомиметических препаратов в комбинации с достижением нормоволемии увеличением объема проводимой инфузии. У пациентов со сниженным СВ на фоне гипотиреоза целесообразно использование бета-симпатомиметических препаратов до его компенсации тиреоидными гормонами [14].
Границами нормального среднего артериального давления (АДср) принято считать 70 – 110 мм.рт.ст. Очевидно, что колебания АДср в этих пределах приведет к изменению церебрального перфузионнного давления (ЦПД), а также перфузии мозга только при нарушении ауторегуляции церебрального кровотока [17]. Поддержание адекватной перфузии мозга является актуальной задачей для раннего послеоперационного периода [17]. В настоящее время отсутствуют общепризнанные уровни среднего АД, достижение которых необходимо у пациентов с опухолями ХСО в послеоперационном периоде, как при развитии у них АГ, так и при формально нормальном уровне АД, но наличия осложненного варианта течения послеоперационного периода, при котором пациент нуждается в пребывании в отделении реанимации для проведения интенсивной терапии. Таким образом, целью проведенного исследования было определение критериев адекватного АДср у пациентов с опухолями ХСО и осложненным течением послеоперационного периода для улучшения исходов лечения.
Материалы и методы
Наше проспективное исследование проводилось на больных, оперированных в Институте нейрохирургии в период с января 2011 по январь 2012 года. Критерии включения: 1. взрослые пациенты; 2. опухоль ХСО; 3. ранний послеоперационный период (семь суток после операции); 4. осложненный послеоперационный период. Под осложненным послеоперационным периодом понималось состояние, при котором после операции требовалось замещение средствами и методами интенсивной терапии нарушенных функций жизненно важных органов и систем (коррекция измененного уровня сознания, АГ, дыхательной недостаточности, пареза желудочно-кишечного тракта, выраженных водно-электролитных и гормональных нарушений). Критерии исключения: 1. три балла по шкале комы Глазго (атоническая кома) на вторые сутки после операции; 2. острый инфаркт миокарда; 3. отек мозга, по данным КТ-исследования головного мозга; 4. ишемический инсульт в бассейне крупных артерий основания мозга (интраоперационное ранение артерий или другие причины их периоперационной окклюзии); 5. интракраниальное кровоизлияние. В исследование включались все последовательно поступавшие в отделение реанимации пациенты, удовлетворявшие критериям включения и имевшие осложненный послеоперационный период. Набор пациентов с неосложненным течением послеоперационного периода носил характер случайной выборки. Для проведения корректного статистического анализа количество этих пациентов было ограничено таким образом, чтобы оно было сопоставимо с численностью больных с осложненным течением послеоперационного периода.
Всем пациентам, включенным в исследование, в первые послеоперационные сутки проводилось спиральное КТ-исследование головного мозга аппаратом CereTom (Neurologica, USA). В дальнейшем КТ-исследования выполнялись по клиническим показаниям, но не реже одного раза в неделю. Проводился стандартный для отделения реанимации мониторинг функции жизненноважных органов и лабораторных показателей: неинвазивный или инвазивный (при развитии АГ) мониторинг АД, пульсоксиметрия, мониторинг внутрибрюшного давления, клинический анализ крови и мочи, биохимический анализ крови (электролиты. глюкоза, альбумин, общий белок, мочевина, креатинин, трансаминазы), анализ гормонального статуса. Кроме этого, всем пациентам ретроградно катетеризировалась внутренняя яремная вена так, чтобы дистальный конец катетера находился в луковице яремной вены. Осуществлялась рентгенологическая верификация положения катетера. Целью катетеризации внутренней яремной вены был забор оттекающей от мозга крови, сатурация (SjvO2) которой свидетельствует об адекватности мозгового кровотока метаболическим потребностям мозга (норма 60–80%). Центральный венозный катетер позиционировался таким образом, чтобы его дистальный конец при рентгенографии грудной клетки визуализировался в проекции правого предсердия. Это делалось для забора центральной венозной крови, сатурация (ScvO2) которой свидетельствует об адекватности перфузии органов их метаболическим потребностям (норма: 65-80%). Забор крови производился одновременно из луковицы внутренней яремной вены и правого предсердия. Исследование газового состава крови осуществлялось на газовом анализаторе ABL 800 FLEX (Radiometer, Copenhagen, Denmark). В каждой из проб регистрировались значения сатурации и лактата. Нормальным уровнем лактата как для крови, оттекающей от мозга (LACjv), так и центральной венозной крови (LACcv) считался 0,5-2,2 ммоль/л [8]. Все измерения венозной крови производились на фоне нормовентиляции (РаСО2 артериальной крови 35-45 мм.рт.ст.), нормооксии (раО2 80-100 мм.рт.ст.) и нормального уровня гемоглобина (Hb>8 г/дл). У пациентов с неосложненным течением послеоперационного периода исследования центральной венозной крови и крови, оттекающей от мозга, проводилось в течение первых послеоперационных суток, каждые 6 часов – на 6-ой, 12-ый, 18-ый и 24-ый час – всего 4 пары измерений. При каждом заборе крови регистрировалось АДср, на фоне которого оно производилось. У пациентов с осложненным течением послеоперационного периода, но стабильным АД, исследования центральной венозной крови и крови, оттекающей от мозга, проводилось в течение трех послеоперационных суток, каждые 6 часов (12 пар измерений). При каждом заборе крови регистрировалось АДср, на фоне которого оно производилось. Стабильным АД считался уровень АДср в пределах 70 – 110 мм.рт.ст. Соответственно, АГ считалось снижение АДср ниже 70 мм.рт.ст. АД корригировалось незамедлительно при развитии АГ [14]. У пациентов с осложненным течением послеоперационного периода и эпизодом АГ исследования центральной венозной крови и крови, оттекающей от мозга, проводилось на разных уровнях среднего АД: 70, 80, 90, 100, 110 мм.рт.ст. (5 пар измерений). Необходимое АДср достигалось изменением скорости инфузии альфа-симпатомиметических препаратов, введение которых проводилось исключительно после коррекции гиповолемии. У пациентов с гипотиреозом одновременно с этим проводилась коррекция дозы используемых тиреоидных гормонов и осуществлялась инфузия бета-симпатомиметических препаратов. Таким образом, для достижения необходимого уровня АДср использовался разработанный ранее алгоритм [14]. В дальнейшем, в течение всего раннего послеоперационного периода, поддерживался тот уровень АДср, при котором SjvO2 и ScvO2 были максимальными, а лактат в крови обеих вен - минимальным. По-сути, так происходила оптимизация АДср.
Основными задачами исследования являлись:
Определение уровней SjvO2, ScvO2, LACjv и LACcv, характерных для пациентов с опухолями ХСО и неосложненным течением раннего послеоперационного периода.
Определение уровня АДср у пациентов с развившейся в раннем послеоперационном периоде артериальной гипотензией, при котором SjvO2, ScvO2, LACjv и LACcv наиболее приближены к этим показателям у пациентов с неосложненным течением послеоперационного периода.
Сравнение исходов пациентов, имевших неосложненное течение послеоперационного периода, с исходами пациентов, имевших осложненное течение послеоперационного периода без эпизодов артериальной гипотензии, и исходов пациентов с осложненным течением послеоперационного периода и эпизодом артериальной гипотензии, но которым АДср искусственно поддерживали на уровне, при котором значения SjvO2, ScvO2, LACjv и LACcv были максимально приближены к этим значениям у пациентов с неосложненным течением послеоперационного периода.
Исходы оценивались по шкале исходов Глазго (ШИГ): 1 – летальный исход; 2 – вегетативное состояние; 3 – тяжелая инвалидизация (пациент требует постоянного ухода за ним); 4 – умеренная инвалидизация (пациент не нуждается в постороннем уходе, но он неработоспособен); 5 – хорошее восстановление (пациент работоспособен). ШИГ 1-3 считается неблагоприятным исходом, ШИГ 4-5 – благоприятным. Причины летального исхода анализировались. Учитывалась длительность пребывания пациента в отделении реанимации.
Для статистического анализа были применены методы непараметрической статистики в программе Statistica 7.0. Для оценки статистической значимости различий использовались следующие критерии: критерий Mann-Witney при сравнении показателей двух независимых групп; критерий Wilcoxon при сравнении показателей двух зависимых групп; критерий Kruskal-Wallis при сравнении показателей трех и более независимых групп; критерий Friedman с расчётом коэффициента Kendall при сравнении показателей трех зависимых групп. Все данные представлены в виде медианы, а разброс в виде верхнего и нижнего квартилей.
Результаты исследования и их обсуждение
Анализ общих данных
В исследование вошло 30 пациентов, 14 из которых были женщины. Медиана возраста составила 47,5 лет. У 11 пациентов была аденома гипофиза, у 9 – менингиома ХСО, у 7 – краниофарингиома, у 2 – хордома ХСО и у 1 – глиома ХСО. Пациенты были разделены на три группы. Группу 1 (n=11) составили больные с неосложненным течением послеоперационного периода. Группу 2 (n=12) составили пациенты с осложненным течением послеоперационного периода, но со стабильным АД. Группу 3 (n=7) составили пациенты с осложненным течением послеоперационного периода и эпизодом артериальной гипотензии. Группы не отличались по полу, возрасту и нейрохирургической патологии.
Анализ полученных значений ScvO2
Медиана ScvO2 во всех группах была в пределах нормы. Нормальным уровнем ScvO2 в нашем исследовании считался уровень 65-80%. В отдельных работах нормальным уровнем ScvO2 считается уровень 70-80% [16]. При выборе критериев нормы для ScvO2 мы, прежде всего, руководствовались работой Pearse R. с соавт, которые показали, что исходы лечения у хирургических пациентов достоверно улучшались, если ScvO2 превышала 64,4% [12]. Другие авторы нормальным уровнем ScvO2 считают уровень 65-80% [10, 15, 18]. Таким образом, по нашему мнению, именно 65% следует считать нижней границей нормальной ScvO2, поскольку дальнейшее ее повышение не улучшает исходов, но за счет нарастания агрессивности интенсивной терапии (увеличение объема инфузии, дозы симпатомиметических препаратов) увеличивает вероятность развития таких ятрогенных осложнений, как отек легких, нарушения ритма сердца, инфаркт миокарда и т.д.
На рисунке 1 показана медиана ScvO2 для группы 1 и 2: 1.1 – 1.4 - это значения ScvO2 на 6-ой, 12-ый, 18-ый и 24-ый час первых суток как для группы 1, так и для группы 2; 2.1 – 3.4 – это значения ScvO2 в группе 2 на вторые и третьи сутки исследования (измерения каждые шесть часов).
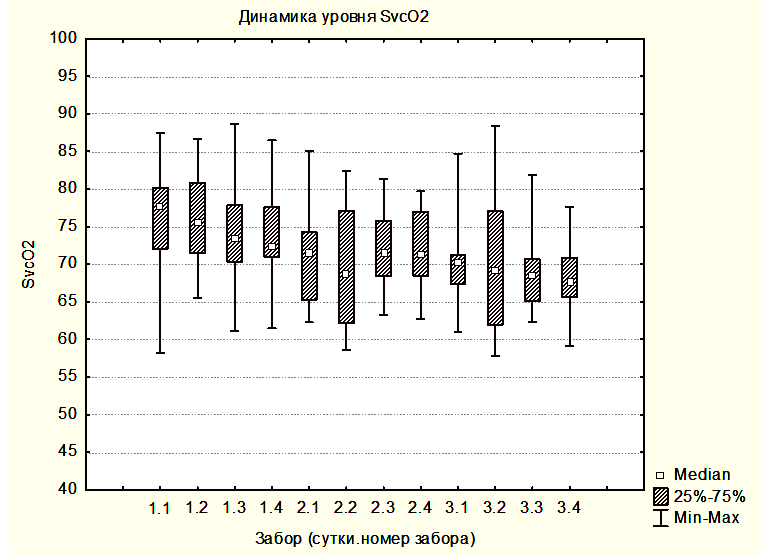
На рисунке 2 показана медиана ScvO2 для группы 3 – забор крови производился на разных уровнях АДср.
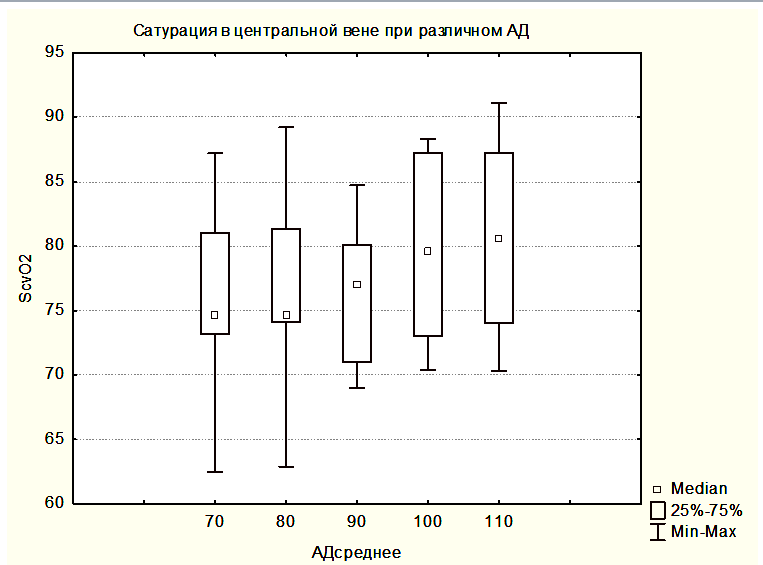
Полученный нами нормальный уровень медианы ScvO2 во всех группах свидетельствует о том, что в отличие от общехирургических пациентов, для которых ScvO2 может служить целевым критерием оптимального АД, для пациентов с опухолями ХСО в раннем послеоперационном периоде ScvO2 не может являться ориентиром для оптимизации АД. Нет предпосылок считать, что сатурация смешанной венозной крови (SvO2), измеряемая в легочной артерии при помощи катетера Свана-Ганса, была бы более пригодной в качестве критерия оптимизации АД. Это утверждение основано на данных литературы, что для популяции нейрохирургических пациентов ScvO2 и SvO2 взаимозаменяемы [7]. Как правило, ScvO2 превышает SvO2 на несколько процентов, но динамика измения этих параметров однонаправленная [13].
ScvO2 во всех измерениях была статистически достоверно выше, чем SjvO2. Эти данные показывают, что у пациентов с опухолями ХСО в раннем послеоперационном периоде при адекватном системном кровотоке может страдать мозговой кровоток. Гипотетически, учитывая то, что из исследования были исключены все пациенты, у которых развивались повреждения зон мозга, не связанных с диэнцефальной областью, можно предположить, что снижение SjvO2 свидетельствует, прежде всего, о перфузии, неадекватной метаболическим потребностям структур, находящихся именно в зоне операции. Следовательно, для оптимизации АД у пациентов после удаления опухолей ХСО следует использовать SjvO2, а не ScvO2.
Анализ полученных значений SjvO2
Нормальным уровнем SjvO2 в нашем исследовании считался уровень 60–80%. При выборе критериев нормы для SjvO2 мы руководствовались мнением Greenberg M.S. [9]. Некоторые авторы считают нормальным уровнем SjvO2 55-75% [13, 20]. Однако поддержание SjvO2 на уровне 55-59% не способно надежно предотвратить церебральную ишемию, поскольку SjvO2 50% уже является лабораторным проявлением ишемического повреждения мозга [5, 6].
Оптимизация АД у нейрореанимационных пациентов возможна при помощи мониторинга SjvO2, церебрального перфузионного давления, напряжения кислорода в веществе мозга (PbrO2), церебрального метаболизма при проведении церебрального микродиализа (МД) или при помощи транскраниальной церебральной оксиметрии. Оптимизировать АД при помощи мониторинга церебрального перфузионного давления целесообразно у пациентов, имеющих внутричерепную гипертензию, которая у больных после удаления опухолей ХСО развивается всего в 3-5% наблюдений [2]. Вследствие низкой частоты развития внутричерепной гипертензии рутинное использование мониторинга церебрального перфузионного давления у изучаемой категории пациентов не целесообразно.
Мониторинг PbrO2 и МД предполагает установку датчика непосредственно в зону предполагаемой гипоперфузии, поскольку дистальный конец датчиков этих мониторных систем не должен находиться далее 1,5 см от очага повреждения [3]. Опухоли ХСО расположены глубинно, поэтому установка датчиков PbrO2 или МД этим пациентам сопряжено с высоким риском ятрогенных интракраниальных осложнений.
Транскраниальная церебральная оксиметрия является неинвазивной методикой. Датчик крепится на кожу в проекции лобных долей и оценивает насыщение гемоглобина кислородом артериальной, венозной и капиллярной крови исключительно коры мозга [4, 11], а не диэнцефальных структур, что делает эту систему также не пригодной для оптимизации АД у пациентов с опухолями ХСО.
Таким образом, измерение SjvO2 является наиболее приемлемым и доступным для рутинного использования методом нейромониторинга, при помощи которого возможна оптимизация АД у пациентов с опухолями ХСО для достижения адекватной перфузии мозга, в том числе, и перфузии диэнцефальных структур.
В группе 1 SjvO2 была на нижней границе нормы и выше, чем у пациентов группы 2 (Рисунок 3).
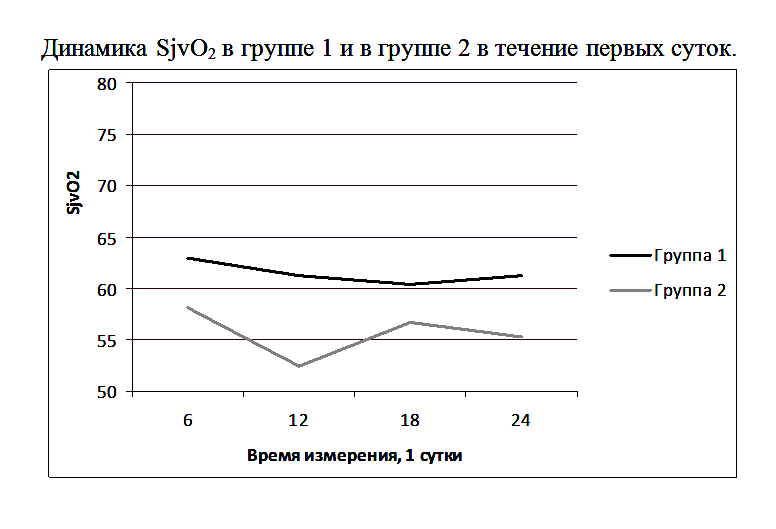
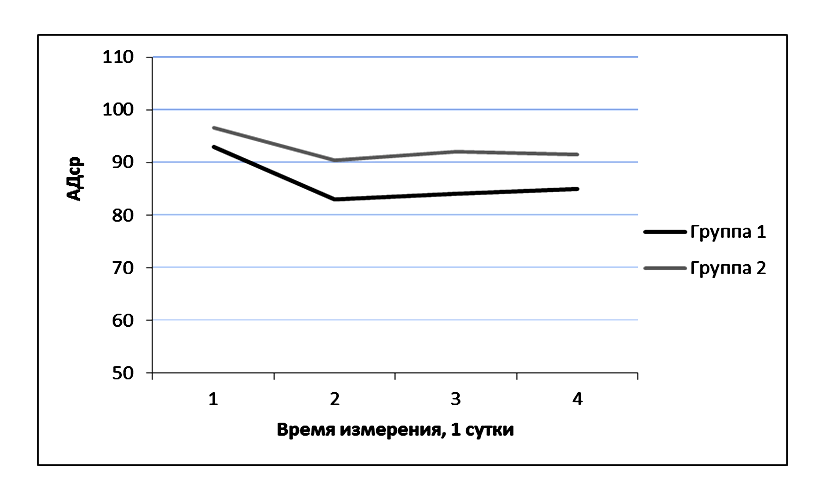
Различия в группах при первом, третьем и четвертом заборе крови (первые сутки измерения: 6, 18, 24 часа) отличались недостоверно, а при втором заборе (первые сутки измерения: 12 часов) отличия были достоверными. При этом уровень АДср был выше у пациентов второй группы: при первом, втором и третьем измерении недостоверно (первые сутки измерения: 6, 12, 18 часов), а при четвертом – достоверно (первые сутки измерения: 24 часа). (Рисунок 4).
Полученные результаты свидетельствуют о том, что при осложненном течении послеоперационного периода у пациентов с опухолями ХСО десатурация венозной крови, оттекающей от мозга, развивается даже в условиях нормального АД. Другими словами, даже при отсутствии артериальной гипотензии у этой категории пациентов увеличена экстракция мозгом кислорода, что является проявлением неадекватной перфузии и, соответственно, церебральной ишемии. Возможно, причиной неадекватной перфузии является даже не абсолютное снижение кровотока в зоне операции, а повышение метаболических потребностей структур мозга в зоне операции, при котором формально нормальные уровни перфузии оказываются неадекватными возросшим после операции метаболическим потребностям.
В группе 2 SjvO2 не достигал нормальных значений на протяжении всех трех суток ее измерения. При этом уровень АДср также не отличался между первыми, вторыми и третьими сутки. Это свидетельствует о том, что нормальный уровень АДср у изучаемой категории пациентов не гарантирует адекватного уровня SjvO2 (Рисунок 4).
В группе 3 SjvO2 было сниженным при АДср в интервале от 70 до 90 мм.рт.ст., и достоверно не отличалось от значений SjvO2 в группе 2. Однако при увеличении АДср до 100-110 мм.рт.ст. уровень SjvO2 возрастал достоверно по сравнению с исходными значениями и достигал значений SjvO2 группы 1, то есть нормальных значений (Рисунок 5).
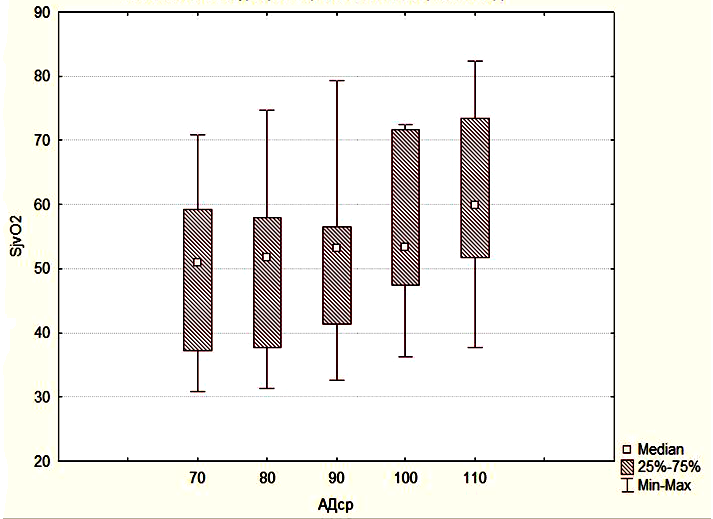
Эти данные показывают, что повышение АДср приводит к достоверному увеличению SjvO2, ее нормализации и достижения уровня, соответствующего пациентам с неосложненным течением послеоперационного периода. АДср в группе 1 было существенно ниже 100 – 110 мм.рт.ст. (Рисунок 6).
Следует подчеркнуть, что достижение и поддержание такого уровня АДср при помощи вазопрессоров не приводило к развитию каких-либо соматических осложнений, связанных с использованием препаратов этой группы. У всех пациентов группы 1 исход был благоприятным (ШИГ=4,5). Медиана длительности пребывания в ОРИТ составила 1 сутки. В группе 2 благоприятный исход был у 10 (83,3%) пациентов, 2 (16,7%) пациента умерли. В одном наблюдении причиной летального исхода было нарушение кровообращения в диэнцефальных структурах (летальный исход на 9 сутки после операции), а в другом – сепсис (летальный исход на 48 сутки после операции). Медиана длительности пребывания в ОРИТ составила 7 суток. В группе 3 благоприятный исход был у 6 (85,7%) пациентов, неблагоприятный исход – в одном (24,3%) наблюдении (ШИГ 3), летальных исходов не было. Медиана длительности пребывания в ОРИТ составила 12 суток. Несмотря на то, что состояние пациентов группы 3 было наиболее тяжелым (у них отмечались эпизоды артериальной гипотензии на фоне осложненного послеоперационного периода, и длительность пребывания в отделении реанимации была наибольшей), у них частота благоприятных исходов не отличалась от частоты благоприятных исходов в группе 2, а летальных исходов не было. Принципиальным отличием в ведении пациентов группы 2 и 3 было поддержание АДср в третьей группе на уровне 100 – 110 мм.рт.ст. Это тот уровень, при котором были получены наибольшие значения SjvO2. Из этого следует, что оптимизация АДср с учетом SjvO2 в раннем послеоперационном периоде, возможно, способна улучшить исходы у пациентов с опухолями ХСО и осложненным течением послеоперационного периода. Однако необходимы дальнейшие исследования с включением большего количества наблюдений для подтверждения этого.
Анализ полученных значений лактата центральной венозной крови и крови, оттекающей от мозга
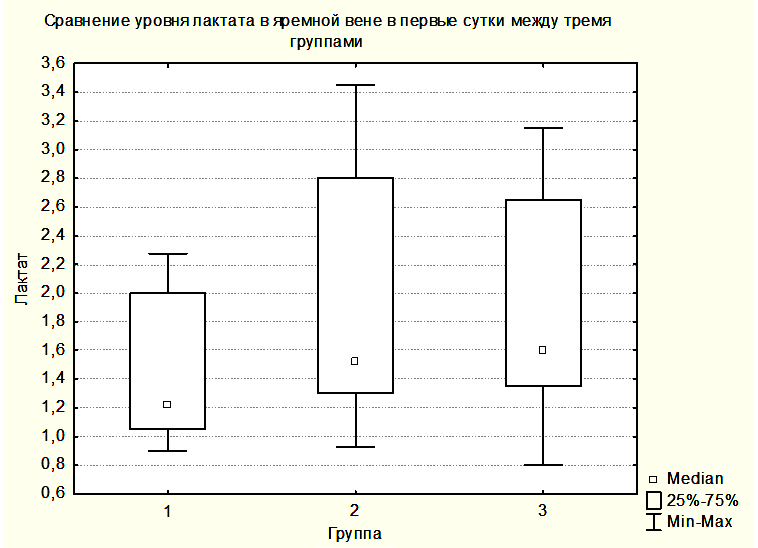
Статистически достоверных закономерностей в динамике уровня лактата в крови центральной вены и в крови, оттекающей от мозга, в различных группах выявлено не было. Однако при всех измерениях уровни лактата в центральной венозной крови не отличались от уровней лактата в крови, оттекающей от мозга. Вероятно, это связано с периодом полувыведения лактата, превышающим 60 минут, а также с тем, что лактат синтезируется и разрушается как в головном мозге, так и в скелетных мышцах, печени, сердце и других органах [15]. Вместе с этим была выявлена тенденция увеличения медианы лактата как в центральной венозной крови, так и в крови, оттекающей от мозга от предыдущей группы к последующей (Рисунки 6,7). При этом медиана уровня лактата центральной венозной крови была выше медианы лактата крови, оттекающей от мозга (Рисунки 6,7), но отличия не были достоверными.
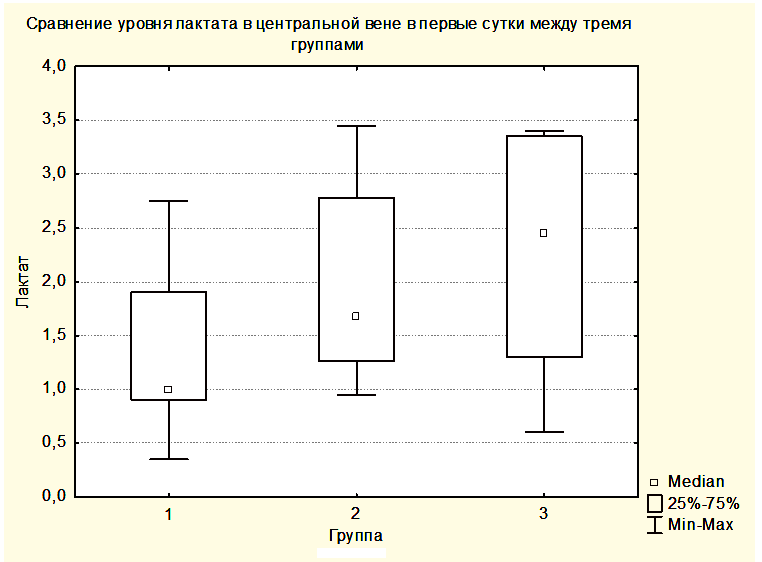
Увеличение медианы уровня лактата в группе 2 по сравнению с группой 1 и в группе 3 по сравнению с группой 2, вероятно, связано с тем, что последующие группы включили в себя более тяжелых пациентов. При повышении уровня АДср у пациентов группы 3 до уровня, приводящему к нормализации SjvO2, медиана лактата оставалась повышенной как в крови, оттекающей от мозга, так и в центральной венозной крови (Рисунки 8,9).
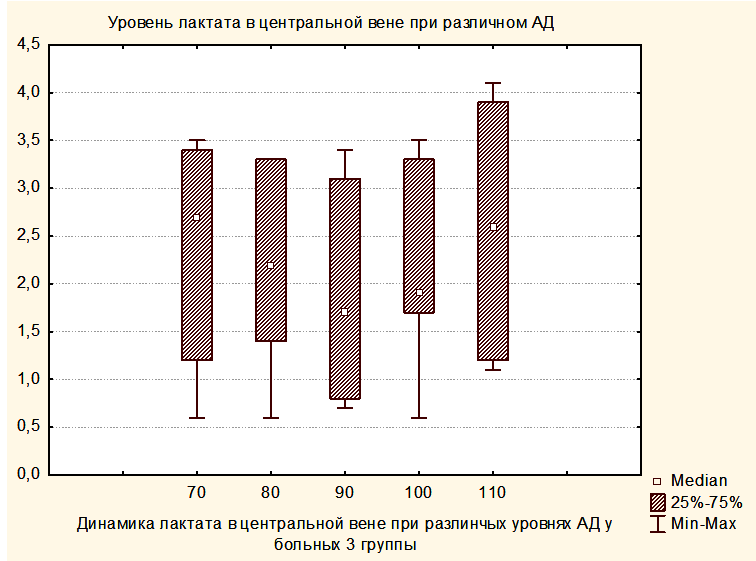
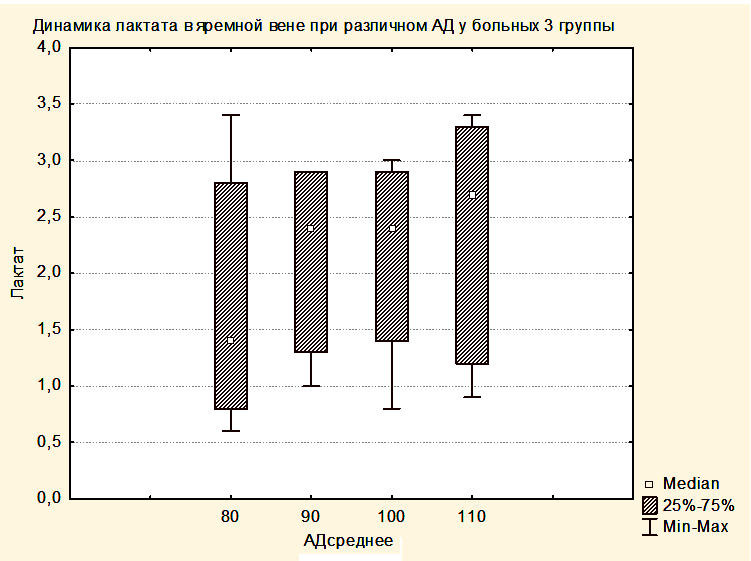
Таким образом, полученные результаты свидетельствуют о том, что уровень лактата не может использоваться в качестве критерия оптимизации АДср у пациентов с опухолями ХСО в раннем послеоперационном периоде.
Выводы:
1.На фоне нормального уровня артериального давления у пациентов не отмечалось снижения ScvO2 как при осложненном, так и при неосложненном течении раннего послеоперационного периода, поэтому ScvO2 не может быть критерием для оптимизации артериального давления у этой категории пациентов.
2.У пациентов с опухолями ХСО при неосложненном течении раннего послеоперационного периода SjvO2 соответствуют нижней границе нормы.
3.При осложненном течении послеоперационного периода у пациентов, у которых отсутствовал эпизод артериальной гипотензии (АДср=80-90 мм.рт.ст), выявлялись сниженные значения SjvO2, которые сохранялись на протяжении всего раннего послеоперационного периода.
4.У пациентов с опухолями ХСО, осложненным течением раннего послеоперационного периода и эпизодом артериальной гипотензии, SjvO2 достигает нормальных значений только при повышении АДср до 100 – 110 мм.рт.ст. методами интенсивной терапии. Тогда как при АДср 70, 80 и 90 мм.рт.ст. SvjO2 остается сниженной.
5.Оптимизацией АД, достигаемой повышением уровня SjvO2, можно улучшить исход у пациентов с опухолями ХСО и осложненным течением раннего послеоперационного давления. Дальнейшие исследования необходимы для подтверждения этого вывода.
6.При осложненном течении послеоперационного периода следует или поддерживать АДср на уровне 100 – 110 мм.рт.ст, или оптимизировать АДср под контролем SjvO2.
Литература
1.Аденомы гипофиза: клиника, диагностика, лечение// Под ред. Б.А. Кадашева. М.-Тверь: ООО «Издательство Триада», 2007. 368 с. 2.Попугаев К.А., Савин И.А., Горячев А.С. и соавт. Синдром диэнцефальной дисфункции.// Анестезиология и реаниматология. 2012, принята в печать. 3.Andrews P.J., Citerio G., Longhi L., et al. Neuro-Intensive Care and Emergency Medicine (NICEM), Section of the European Society of Intensive Care Medicine NICEM consensus on neurological monitoring in acute neurological disease.// Intensive Care Med. 2008:V.34, p.1362–1370. 4.Dagal A, Lam A.M. Cerebral blood flow and the injured brain: how should we monitor and manipulate it?// Curr Opin Anaesthesiol. 2011:V.24, p.131-137. 5.Dearden N.M. Jugular bulb venous oxygen saturation in the management of severe head injury.// Current Opinion in Anaesthesiology. 1991:V.4, p.279–286. 6.De Deyne C., Decruyenaere J., Colardyn F. How to interpret jugular bulb oximetry? In: Vincent J.L., ed. Yearbook of Intensive Care and Emergency Medicine. Berlin: Springer-Verlag, 1996;731–41 7.Dueck M.H., Klimek M., Appenrodt S., et al. Trends but not individual values of central venous oxygen saturation agree with mixed venous oxygen saturation during varying hemodynamic conditions.// Anesthesiology. 2005:V.103, p.249–257 8.Gennari F.J., Adrogue H.J., Galla J.H., Madias N.E. Acid-base disorders and their treatment.// 2005: Taylor and Francis Group, Boca Raton, Fl. 9.Greenberg M.S. Handbook of neurosurgery.// 7th edition. 2010, Thieme, New York. 10.Hutter A.M. Jnr, Moss A.J. Central venous oxygen saturations. Value of serial determinations in patients with acute myocardial infarction.// JAMA. 1970:V.212, p.299-303. 11.Panerai R.B. Complexity of the human cerebral circulation.// Philos Trans A Math Phys Eng Sci. 2009: V.367, p.1319-1336. 12.Pearse R., Dawson D., Fawcett J., et al. Changes in central venous saturation after major surgery, and association with outcome.// Critical Care. 2005:V.9, p.R694-R699. 13.Pinsky M.R., Payen D. Functional hemodynamic monitoring.// 2006, Springer-Verlag Berlin Heidelberg. 14.Popugaev K.A., Savin I.A., Goriachev A.S., Kadashev B.A. Hypothalamic injury as a cause of refractory hypotension after sellar region tumor surgery.// Neurocrit Care. 2008:V.8, p.366-73. 15.Rady M.Y., Rivers E.P., Martin G.B., et al. Continuous central venous oximetry and shock index in the emergency department: use in the evaluation of clinical shock.// Am J Emerg Med. 1992:V.10, p.538-541. 16.Rivers E., Nguyen B., Havstad S., et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock.// N Engl J Med. 2001:V.345, p.1368-1377. 17.Rose J.C., Mayer S.A. Optimizing blood pressure in neurological emergencies.// Neurocrit Care. 2004:V.3, p.287-300. 18.Scalea T.M., Hartnett R.W., Duncan A.O., et al. Central venous oxygen saturation: a useful clinical tool in trauma patients.// J Trauma. 1990:V.30, p.1539-1543. 19.Shoemaker W.C., Appel P., Kram H.B., et al. Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients.// Chest. 1988:V.94, p.1176-1186. Torbey M.T. Neurocritical care.//2010, Cambridge University Press, Cambridge.






