НИИ Нейрохирургии Бурденко, РАМН, Москва
Введение
Общеизвестно, что церебральное перфузионное давление (ЦПД) определяется как разница между средним артериальным (САД) и средним внутричерепным давлениями (ВЧД): ЦПД = САД – ВЧД и измеряется в миллиметрах ртутного столба (мм рт.ст.).
Очень часто клиницисты путают понятия ЦПД и перфузия головного мозга. Что же такое перфузия и почему давление называется перфузионным?
Перфузия – это процесс прохождение крови через ткань или орган. Перфузию оценивают как отношение потока жидкости сквозь ткань к массе этой ткани. В нашем случае перфузия – это отношение объемного мозгового кровотока к массе мозгового вещества. Она измеряется в миллилитрах крови на 100 гр. ткани в минуту (мл/ 100 г/ мин). Усредненный объемный мозговой кровоток в физиологических условиях приблизительно равен 50 мл/100г/мин. Существуют региональные отличия для серого и белого вещества мозга, которые варьируют от 70 до 20 мл/100г/мин., соответственно. Нижние границы мозгового кровотока, при которых развиваются гипоперфузия и церебральная ишемия, хорошо изучены и установлены в экспериментальных работах: мозговой кровоток менее 30мл/100г/мин вызывает развитие неврологической симптоматики и изменение функциональной активности нейронов; при снижении до 15-20 мл/100 г/мин развиваются обратимые нарушения на уровне дисфункции мембран нейронов; при снижении кровотока менее 10-15 мл/100г/мин развивается необратимые нейрональное повреждение и гибель нейронов [1;9;10;32]. Однако, следует помнить, что развитие деструктивных морфологических изменений в мозговой ткани зависит не только от степени, но и от длительности ишемии [11;32].
В гидродинамике, как и в электродинамике для расчета силы тока (жидкости или электричества) используется закон Ома I=U/R. В электродинамике – это отношение напряжения или разности потенциалов к сопротивлению, а в гидродинамике – это отношение разности давлений в начале и конце трубки, или системы трубок, к сопротивлению. Таким образом, объемная скорость жидкости прямо пропорциональна разнице давлений и обратно пропорциональна гидродинамическому сопротивлению. Разность давлений, или градиент давлений, создающий поток крови через ткань и называют перфузионным давлением. В тканях организма перфузионное давление определяется градиентом давлений между артериальным и венозным руслом. В клинической практике мы используем ЦПД, как суррогатный показатель перфузии мозга, в виду отсутствия других доступных методов измерения. В соответствии с законом Ома перфузия мозга, или объемный мозговой кровоток, описывается формулой CBF = СРР / CVR, где CBF- объемный кровоток, СРР - церебральное перфузионное давление, CVR- сопротивление церебральных сосудов [2; 9].
Измерение ЦПД.
В нормальных физиологических условиях ВЧД близко к давлению венозных синусах мозга, поэтому ЦПД при нормальном состоянии приравнивается артерио-венозному градиенту. При патологических состояниях мозга сопровождающихся повышенным давлением в полости черепа: отеке мозга, нарушении циркуляции ликвора, появлении патологического масс-эффекта - происходит компрессия вен в местах впадения в синусы мозга. Все это приводит к нарушению венозного оттока и, в конечном счете, способствует дальнейшему росту ВЧД. При этом ВЧД значительно превосходит давление в венозных синусах мозга. В создавшихся условиях перфузия ткани мозга будет зависеть от градиента между САД и ВЧД.
Измерение ЦПД возможно при условии измерения артериального и внутричерепного давления. В условиях отделений нейроинтенсивной терапии данные измерения проводятся прикроватного, инвазивно и в непрерывном режиме. Общеизвестно, что для расчета ЦПД используют среднее артериальное давление (САД). Установлено, что САД определяет перфузию тканей организма и остается относительно неизменным на всем протяжении артериального русла [6;42]. Для правильного измерения ЦПД при горизонтальном положении тела датчик измерения инвазивного АД должен располагаться на уровне левого предсердия. При положении тела с приподнятым головным концом датчик должен размещаться на уровне наружного слухового прохода. Так обеспечивается положение датчика на уровне Виллизиева круга сосудов головного мозга, что гарантирует более точное измерение ЦПД [3;41]. Если в положении приподнятого головного конца под углом 15-450 расположить датчик инвазивного артериального давления на уровне левого предсердия, то может происходить искусственное завышение ЦПД на 10-20 мм рт.ст. так как свой вклад будет вносить возросший уровень гидростатического давления. Неправильное измерение ЦПД может влиять на принятие решения о терапии, затруднять своевременную диагностику гипо- и гиперперфузии мозга и, как следствие, ухудшать исходы заболевания [41].
ЦПД и ауторегуляция мозгового кровотока.
Закон Ома позволяет считать ЦПД суррогатным маркером мозгового кровотока [2;9]. Другим не менее значимым фактором, определяющим интенсивность объёмного мозгового кровотока, является сопротивление церебральных сосудов. В норме, у здорового человека работают механизмы ауторегуляции тонуса мозговых сосудов. В соответствии с уравнением Ома, ауторегуляция обеспечивает адекватное сопротивление мозговых сосудов в ответ на изменения ЦПД и, тем самым, поддерживает постоянство объемного кровотока, отвечая метаболическим потребностям мозга [1; 2; 9]. Ауторегуляция тонуса мозговых сосудов – сложный многокомпонентный физиологический механизм регуляции тонуса мозговых сосудов, обеспечивающий адекватность церебрального кровотока, оксигенации и метаболизма. В основе ауторегуляции лежит способность гладкомышечных клеток регионарных сосудов к повышению сократительной активности при увеличении растяжения сосудов под действием перфузионного давления или к ее уменьшению при ослаблении растяжения в условиях снижения перфузионного давления. Основные компоненты ауторегуляции мозговых сосудов – это миогенный, гуморальный, метаболический, нейрогенный, эндотелиальный [1;2;4;5;9].
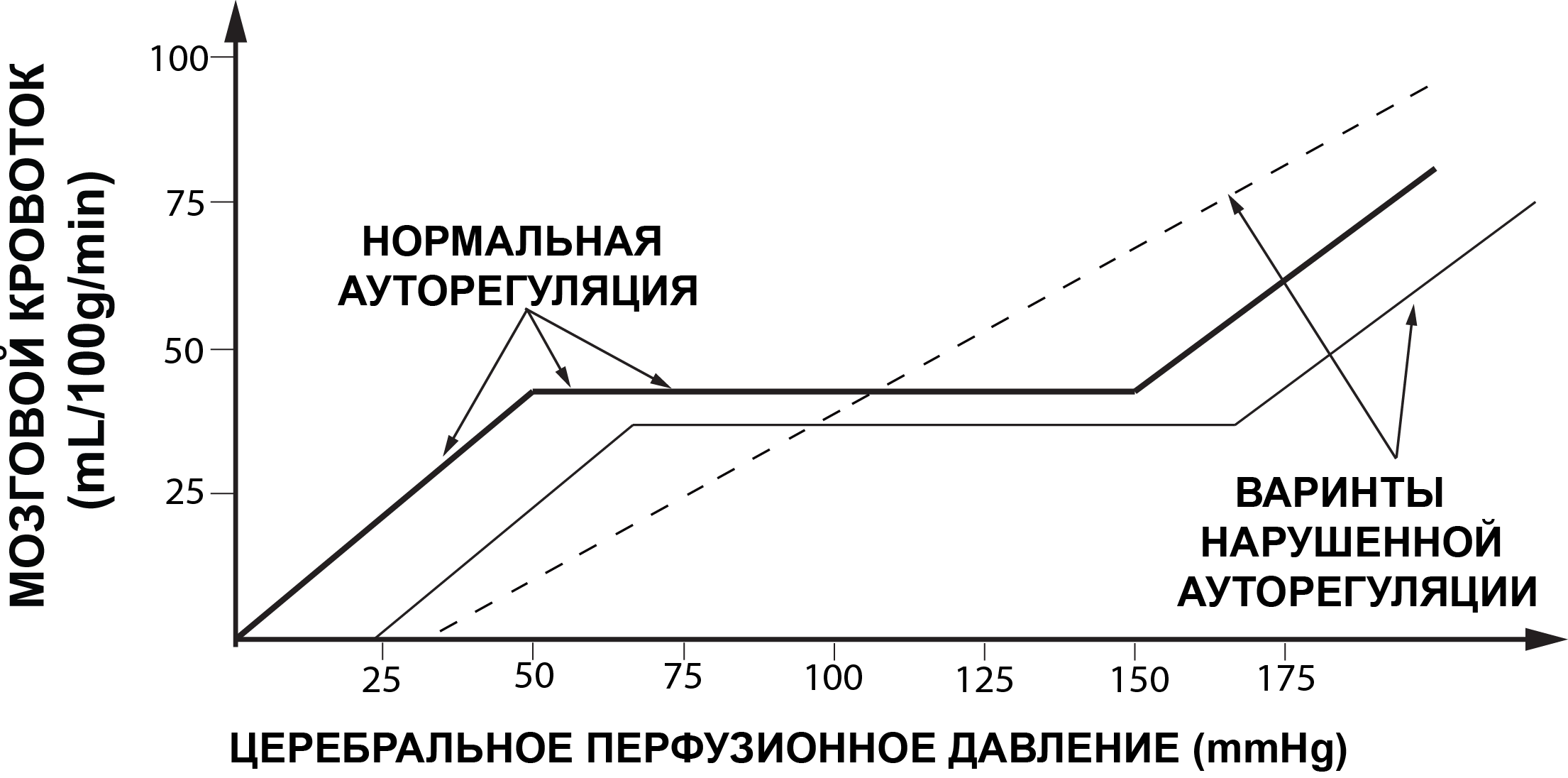
При нормальных физиологических условиях границы ЦПД (Рис. 1) здорового человека лежат в пределах от 50 до 150мм рт.ст.[43]. В пределах указанных границ ЦПД обеспечивается постоянный адекватный объемный мозговой кровоток. Снижение ЦПД ниже 50 мм рт.ст. может приводить к ишемии мозга, а повышение ЦПД выше 150 мм рт.ст. - к гиперемии мозга (Рис. 2).
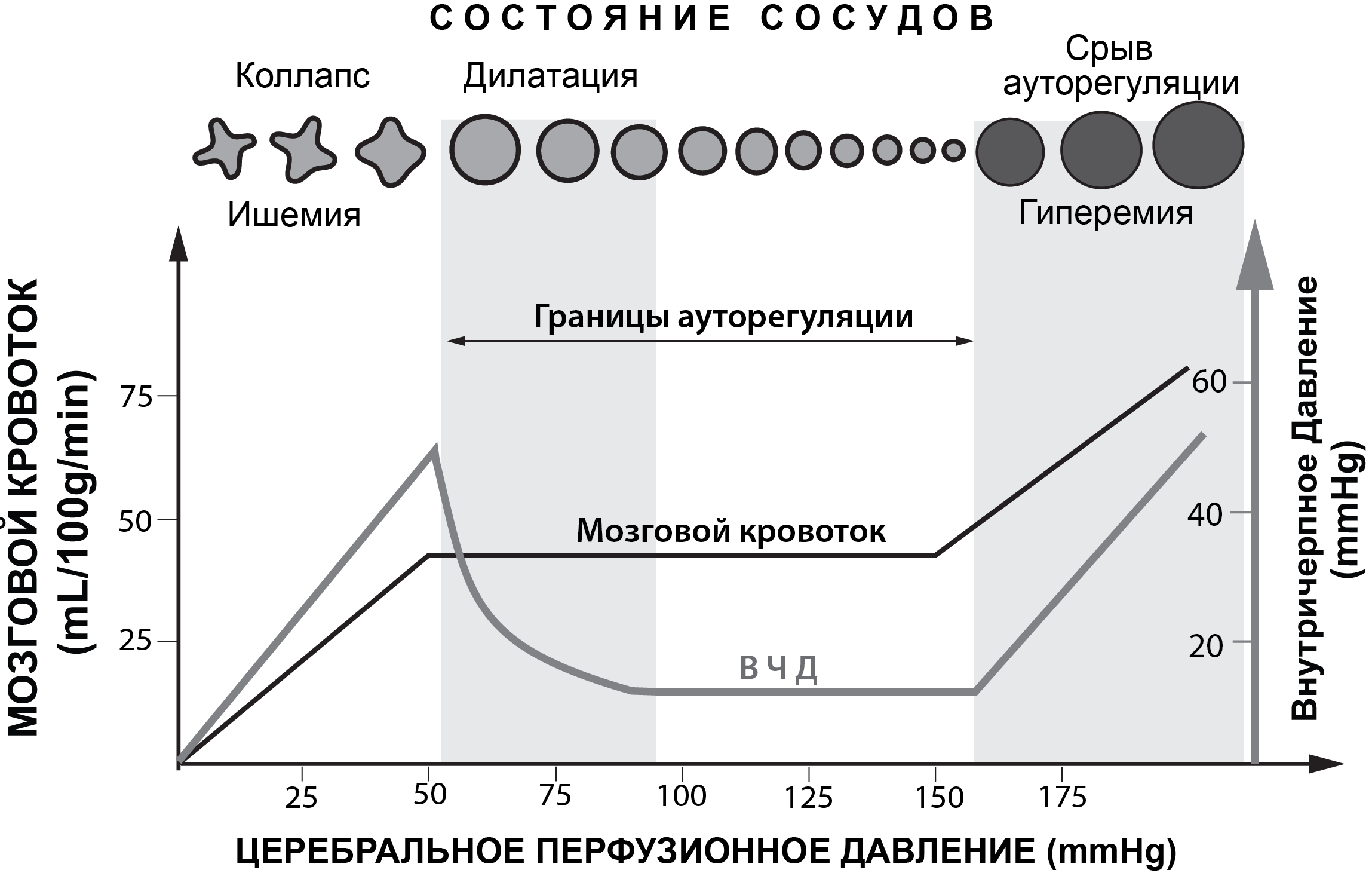
При различных патологических состояниях головного мозга (ЧМТ, САК, ОНМК) ауторегуляция мозговых сосудов может нарушаться. Это означает, что резистивные сосуды плохо обеспечивают постоянство объемного кровотока на фоне изменяющегося АД, изменения газового состава ткани мозга и крови и т.д. В этих патологических условиях мозговой кровоток напрямую зависит от значения ЦПД.
Контроль и обеспечение ЦПД при ЧМТ.
Церебральная ишемия, развивающаяся в остром периоде ЧМТ, остается одним из важных факторов вторичного повреждения мозга, который определяет исход травмы [25;38]. Поддержание церебрального перфузионного давления (ЦПД) у пострадавших с ЧМТ является общепризнанным методом предупреждения развития вторичной ишемии мозга. Согласно данным мировой литературы, ЦПД является независимым прогностическим критерием исхода при ЧМТ [18;37]. Основной причиной снижения церебральной перфузии при ЧМТ является артериальная гипотония. Устранение причин гипоперфузии введено в стандарт оказания первой помощи пострадавших с ЧМТ[29]. Подходы к контролю и обеспечению ЦПД претерпевали изменения, начиная с внедрения первых протоколов лечения пострадавших с ЧМТ. В 60-70-х годах, когда был внедрен мониторинг ВЧД по методу Lunberg, измерению ЦПД не предавалось должного внимания. Основной задачей при ведении пострадавших с ЧМТ считалась коррекция ВЧД. Самый ранний ВЧД-протокол включал в себя такие терапевтические опции, как наружное вентрикулярное дренирование ликвора, гипервентиляцию, использование седативных препаратов, релаксантов, гиперосмолярных растворов и декомпрессивной трепанации [29;36;37;38].
В середине 80-х годов появилась новая концепция ведения пациентов с травматическим поражением головного мозга. В основе концепции, предложенной Rosner et al., лежал каскад вазодилатации и вазоконстрикции. Данная концепция послужила развитию нового направления терапии пострадавших с травматическим поражением головного мозга, а именно, ЦПД-протоколу [48;49;50;51]. По мнению Rosner et al., при ЧМТ границы ауторегуляции мозговых сосудов «смещаются вправо» к более высоким значениям ЦПД. Суть концепции заключается в том, что не зависимо от причин, приводящих к снижению ЦПД, это всегда приводит к вазодилатации мозговых сосудов и увеличению объемного кровотока (внутричерепного содержания крови). Это в свою очередь вызывает повышение ВЧД, что закономерно приводит к дальнейшему снижению ЦПД и, таким образом, причинно-следственный каскад замыкается и повторяется вновь и вновь, приводя к ишемическому повреждение головного мозга. Для разрыва данного патологического круга достаточно повысить перфузионное давление, что приведет к вазоконстрикции мозговых сосудов, уменьшению объемного кровотока и снижению ВЧД. Согласно концепции авторов, для обеспечения адекватного мозгового кровотока и контроля над ВЧД, необходимо поддерживать более высокие значения ЦПД. В дальнейшем ЦПД - протокол был включен в первое международное руководство по ведению ЧМТ и сводился к поддержанию ЦПД выше 70 мм рт.ст. Поддержание ЦПД обеспечивалось инфузионной терапией и введением катехоламинов. Внедрение ЦПД-протокола обеспечило снижение летальности в группе пострадавших с тяжелой ЧМТ с 50% до 35-26% [36;49;55]. Интересно отметить, что с момента внедрения первого ЦПД – протокола и по сегодняшний день произошел пересмотр границ безопасного ЦПД (Таблица №1).

Если на ранних этапах развития делался акцент только на нижние границы допустимого ЦПД, ниже которого считалось нельзя допускать снижения ЦПД из-за риска развития церебральной ишемии, то в настоящее время обсуждается и необоснованность агрессивного обеспечения высоких значений ЦПД. Это обусловлено риском развития различных интра - и экстракраниальных осложнений [15;19].
Альтернативным протоколом по значению безопасного уровня ЦПД является протокол Лунд. Данный протокол, ориентирован на контроль ВЧД. Основной целью протокола является управление внутричерепными объемами за счет снижения транскаппилярной фильтрации, обеспечения целостности гемато-энцефалического барьера, снижения метаболизма мозга, нормализации тонуса прекаппилярных артериол, поддержания коллоидно-онкотического давления. Согласно концепции, высокое АД и повышенное ЦПД являются потенциально опасными, так как провоцируют отек мозга за счет усиления транскаппилярной фильтрации. Терапия ориентирована на снижение АД и понижение ЦПД до 50 мм рт.ст. Обеспечение безопасного уровня ЦПД авторы подтверждали с помощью церебрального микродиализа, контролируя уровень метаболизма мозга [21;26;27]. Разработчики Лунд-протокола утверждали, что он обеспечивает снижение летальности (до 8%) и увеличивает количество благоприятных исходов (до 80%)[21].
Итак, Лунд-протокол был ориентирован на снижение ВЧД< 20 мм рт.ст. и обеспечение ЦПД в пределах 50-60 мм рт.ст. Несмотря на значительные расхождения по ЦПД между существовавшими протоколами, в третьей редакции международных рекомендаций по ведению пострадавших с ЧМТ, были пересмотрены и снижены границы ЦПД, внесено ограничение по агрессивному поддержанию ЦПД (Таблица №1). В проспективном исследовании, проведенном Robertson et al., авторы сравнили два уровня обеспечения ЦПД. Одной группе пострадавших с ЧМТ обеспечивали ЦПД>50 мм рт.ст., а другой >70 мм рт.ст. В группе с ЦПД выше 70 мм рт.ст. значительно меньше было эпизодов церебральной ишемии, но при этом не было улучшения исходов заболевания. Авторы связали это с возросшим числом соматических осложнений, чаще в виде респираторного дистресс-синдрома [46].
Таким образом, не было подтверждено преимущество стратегии и положительного эффекта на исходы заболевания при агрессивном обеспечении ЦПД. По результатам этого и ряда других исследований были внесены поправки к существующим рекомендациям по обеспечению ЦПД. Важно отметить, что впервые был ограничен верхний предел ЦПД. Так, согласно последней редакции Guidelines [29], для большинства пострадавших с ЧМТ границы ЦПД должно находиться в пределах 50-70 мм рт.ст. У пострадавших с сохранной ауторегуляцией допускается ЦПД выше 70 мм рт.ст. [29]. ЦПД у пациентов с острым нарушением мозгового кровообращения по ишемическому типу (ОНМК).
Данных о динамике ЦПД и его прогностической значимости у пациентов с ОНМК в литературе практически не встречается. Основной причиной этого является низкая частота встречаемости жизненно угрожающего отека мозга с развитием дислокации. По данным литературы, одно из самых грозных осложнений в виде злокачественного отека при ОНМК в бассейне средней мозговой артерии (СМА) встречается в 10% случаев от всех ишемических инсультов [7;30]. Отсюда следует, что показания для мониторинга ВЧД и ЦПД возникают у этих больных нечасто. В публикациях посвященных интенсивной терапии пациентов с ОНМК неоднократно обсуждался вопрос об адекватности и пользе измерения ВЧД и ЦПД. Так сообщалось, что при полушарных инсультах отрицательная неврологическая симптоматика в виде нарушения сознания, развития гемипареза, афазии, анизокарии, могла развиваться на фоне нормальных значений ВЧД. Ряд авторов достаточно скептически относятся к целесообразности измерения ВЧД и ЦПД при ОНМК и считают, что на данные параметры нельзя ориентироваться при определении лечебной тактики [23;52]. При развитии обширного инфаркта мозга летальность среди пациентов достигала 70-80% даже на фоне мониторинга ВЧД/ЦПД и использовании всего арсенала средств интенсивной терапии: гипервентиляции, седативных препаратов, гиперосмолярных растворов и др. [13;30]. Мета-анализ, проведенный Vahedi et al., на основании трех многоцентровых рандомизированных контролируемых исследований посвященных декомпрессивной трепанации при полушарных инсультах показал, что активная нейрохирургическая тактика снижает летальность и улучшает функциональный исход [54]. Наряду с этим, было сделано важное заключение, что мониторинг ВЧД не влиял на принятие решения о декомпрессивной трепанации. Было так же установлено, что дислокация мозга и неврологическое ухудшение могли развиваться на фоне нормальных значений ВЧД и ЦПД. Таким образом, была показана низкая чувствительность ВЧД мониторинга при выявлении дислокации на фоне ОНМК [54]. В современных рекомендациях по ведению пациентов с ишемическим инсультом основным параметром, обеспечивающим адекватность церебральной гемодинамики, принято считать АД. Артериальная гипотензия при ОНМК встречается редко [17;34]. Установлено, что критическими значениями при ОНМК является АД 100/70 мм рт.ст. [17].
Как следует из вышесказанного, в современной литературе безопасные границы ЦПД при ОНМК не обсуждаются. Это связано с небольшой частотой развития внутричерепной гипертензии у этой категории больных. Злокачественный отек мозга развивается только в 10% случаев от всех инсультов и только при обширных полушарных инфарктах мозга. При данной патологии консервативные методы терапии, ориентированные на ВЧД мониторинг, оказались неэффективными в отличии от декомпрессивной трепанации. В остром периоде ОНМК чаще регистрируется артериальная гипертензия. В международных рекомендациях по лечению больных с инсультом обсуждаются только предельные границы АД, а не границы ЦПД [28]. Так, рекомендуется проводить коррекцию АД только при значениях выше 220/120 мм рт.ст. Коррекция артериальной гипертензии первые 24 часа с момента развития инсульта не должна превышать 15% от исходного значения АД. При показании к внутривенному тромболизису, перед его проведением рекомендуется снизить АД ниже 185/110 мм рт.ст., а после проведения контролировать значение в диапазоне <180/105 мм рт.ст. При невозможности обеспечения указанных значений АД рекомендуется отказаться от проведения тромболизиса из-за риска кровоизлияния [28].
ЦПД у пациентов с внутримозговыми кровоизлияниями (ВМК) нетравматической этиологии.
В доступной нам литературе не удалось оценить частоту развития внутричерепной гипертензии при данной патологии. Однако острота развития масс-эффекта, которая всегда присутствует при ВМК, с последующей дислокацией мозга требуют от нейроинтенсивиста тщательной клинической оценки, мониторинга церебральных параметров ВЧД/ЦПД и выполнения современных рекомендация. Ряд авторов полагает, что частота развития внутричерепной гипертензии у этого контингента больных сопоставима с её частотой при тяжелой ЧМТ [22;57]. В современных руководствах по ведению пациентов с ВМК рекомендовано контролировать ЦПД в пределах 50-70 мм рт.ст. и учитывать состояние ауторегуляции мозговых сосудов [40]. Данные рекомендации практически полностью повторяют рекомендации при тяжелой ЧМТ [29]. Важно отметить, что, как и у пациентов с ишемическим инсультом, при данной патологии острый период чаще сопровождается артериальной гипертензией [44;56].
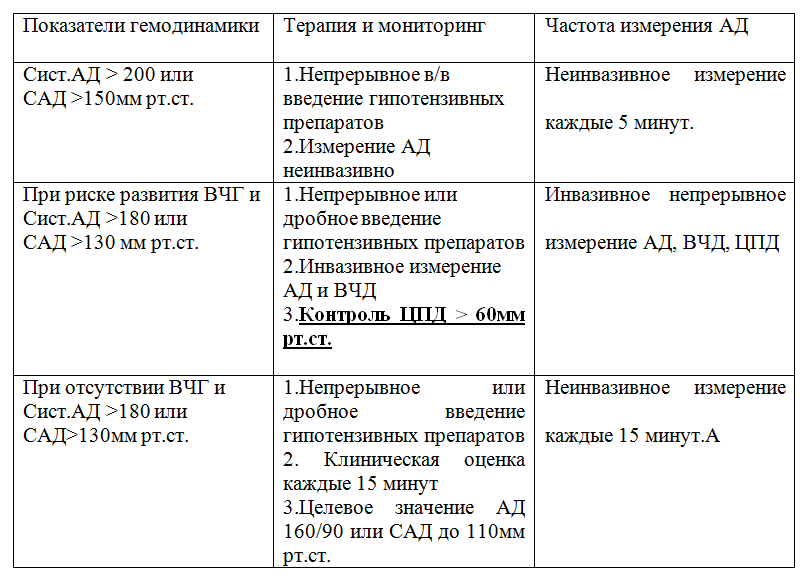
Именно поэтому в рекомендациях в основном обсуждаются верхние границы безопасного АД (Таблица №2): Коррекция артериальной гипертензии проводится незамедлительно и агрессивно при значении систолического АД > 220 или среднего АД (САД) > 150 мм рт.ст. При развитии отека мозга и систолического АД> 180 и САД> 130 мм рт.ст. коррекция гемодинамики должно проводиться под контролем ВЧД и обеспечения ЦПД>60 мм рт.ст. При отсутствии признаков внутричерепной гипертензии, проводится контроль АД, целевым значением становиться АД 160/90 и САД <110 мм рт.ст. У пациентов после декомпрессивной трепанации САД должно быть <100 мм рт.ст. [16; 40].
Стремление клиницистов незамедлительно купировать артериальную гипертензию обусловлено тем, что высокое АД может увеличивать объем кровоизлияния, перифокальный отек вокруг гематомы за счет повышенного гидростатического давления, способствовать повторному кровоизлиянию и, в конечном итоге, ухудшать исход заболевания. В остром периоде ВМК ориентиром для гипотензивной терапии служит уровень безопасного АД. В многочисленных исследованиях при данной патологии предпочтение было отдано контролю систолического АД, так как в отличие от диастолического и САД, оно зарекомендовало себя как надежный фактор предсказания повторного кровоизлияния [44]. Принято считать, что при геморрагическом инсульте высокое АД можно безопасно снижать до уровня систолического АД 140 мм рт.ст. без риска развития гипоперфузии [8]. Но при этом, согласно международным рекомендациям для пациентов с ВМК, границы ЦПД должны находиться в пределах 50-70 мм рт.ст., а при развитии отека и внутричерепной гипертензии ЦПД должно строго контролироваться в пределах выше 60 мм рт.ст.[40]. Таким образом, при лечении пациентов с ВМК наряду с коррекцией артериальной гипертензии, важным аспектом терапии является обеспечение адекватного ЦПД. ЦПД у пациентов с аневризматическим субарахноидальным кровоизлиянием (САК). При рассмотрении данной патологии следует учитывать ряд особенностей в зависимости от сроков с момента кровоизлияния и наличия вазоспазма. Согласно данным литературы частота внутричерепной гипертензии (ВЧГ) при данной патологии весьма вариабельна и составляет от 10 до 54%. Причем внутричерепная гипертензия имеет различные первопричины и может формироваться на разных этапах [31;35].
Первоначально при разрыве аневризм внутричерепная гипертензия развивается в момент прорыва крови из артериального русла. Выраженность внутричерепной гипертензии зависит от объема кровоизлияния, сопутствующего нарушения ликвородинамики, возможности пространственной компенсации краниоспинального пространства. В последующем, в остром периоде, развитие внутричерепной гипертензии может быть связано с гидроцефалией. Начиная с 4-7 суток, после кровоизлияния, ВЧГ может формироваться за счет ишемического отека мозга, как осложнение церебрального вазоспазма. Гипоперфузия мозговой ткани может развиваться на любом из этих этапов заболевания. Безопасные границы АД и ЦПД зависят от 2-х факторов: выключена аневризма или нет, а так же от наличия церебрального вазоспазма. В соответствие с международными рекомендациями у этих больных следует исключить эпизоды артериальной гипотензии менее 100 мм рт.ст. в течение первых 21 суток с момента кровоизлияния. До момента клипирования или эндовазальной эмболизации аневризмы следует контролировать систолическое АД - не выше 160 мм рт.ст. [12]. При развитии церебрального вазоспазма агрессивность интенсивной терапии возрастает и одним из важных ориентиров терапии помимо АД, становится ЦПД. Следует оговориться, что в дальнейшем речь пойдет о самых тяжелых пациентах с оценкой по шкале Хант-Хесс IV-V. Именно у этой группы пациентов чаще развивается вазоспазм, гипоперфузия и церебральная ишемия, они нуждаются в строгом контроле АД и ЦПД. До начала расширенного мониторинга (АД, ЦПД, ВЧД) рекомендуется контролировать среднее АД выше 90 мм рт.ст. С момента начала мониторинга ВЧД/ЦПД целью терапии становиться обеспечение ЦПД выше 70 мм рт.ст. [33;39;47].
Таким образом, контроль ЦПД при САК становиться актуальным только для группы пациентов с высоким риском развития вазоспазма или уже развившимся вазоспазмом мозговых сосудов. Контроль АД и обеспечение ЦПД выше 70 мм рт.ст. принято считать одним из эффективных методов профилактики церебральной ишемии у пациентов с САК [14;47].
Заключение.
ЦПД не может считаться универсальным показателем адекватности мозгового кровотока при различной церебральной патологии.
С целью профилактики и направленной терапии церебральной ишемии целесообразно использовать показатель ЦПД при развитии внутричерепной гипертензии и риске развития церебральной гипоперфузии.
ЦПД имеет приоритетное значении при лечении пациентов с ЧМТ, а так же у пациентов с САК (Хант-Хесс 4-5) и пациентов с ВМК.
Для пациентов с ОНМК и САК (Хант-Хесс 1-3) предпочтение отдается контролю АД.
Литература
- Демченко И.Т. Кровоснабжение бодрствующего мозга. Л. 1983. – 173с.
- Шмидт Р., Тевс Г. Физиология человека. В: Том 2. Костюк П.Г. (ред.) Нервная и гуморальная регуляция. Кровь и кровообращение. Дыхание. М: Мир. 1996. с.333-641.
- Дж.Эдвард Морган-мл., Мэгид С.Михаил. Клиническая анестезиология: книга 1-я/ пер. с англ. М.-СПб: Бином - Невский Диалект, 1998. С.110.
- Aaslid R., Lindegaard K.F., Sorteberg W., Nornes H. Cerebral autoregulation dynamics in humans//Stroke. 1989.V.20. p.45–52.
- Aaslid R., Newell D.W., Stooss R., Sorteberg W., Lindegaard K.F. Assessment of cerebral autoregulation dynamics from simultaneous arterial and venous transcranial Doppler recordings in humans.// Stroke. 1991. V.22. p.1148-1154.
- Abrams J.H, Cerra F, Holcroft J.W. Cardiopulmonary monitoring. In: Wilmore DW (ed.) Care of surgical patient. New York, Scientific American Medicine, 1989.
- Aiyagari V., Diringer M.N. Management of large hemispheric stroke in the neurological intensive care unit.// Neurologist. 2002. V.8. p.152-162.
- Anderson C.S., Huang Y., Wang J.G. INTERACT Investigators. Intensive blood pressure reduction in acute cerebral haemorrhage trial (INTERACT): a randomised pilot trial.// Lancet Neurol. 2008. V.7. p.391–399.
- Arthur C. Guyton, John E. Hall. Textbook of medical physiology: Elsevier. 11th ed. 2006. p.761.
- Astrup J. Energy-requiring cell functions in the ischemic brain. Their critical supply and possible inhibition in protective therapy.// J. Neurosurg. 1982. V.56. p.482-497.
- Astrup J., Siesjö B.K., Symon L. Thresholds in cerebral ischemia - the ischemic penumbra.// Stroke. 1981.V.12. p.723-725.
- Bederson J.B., Connolly E.S. Jr., Batjer H.H., Dacey R.G., Dion J.E., Diringer M.N., Duldner J.E. Jr., Harbaugh R.E., Patel A.B., Rosenwasser R.H. American Heart Association. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association.// Stroke. 2009. V.40. p.994-1025.
- Berrouschot J., Sterker M., Bettin S., Köster J., Schneider D. Mortality of space-occupying ('malignant') middle cerebral artery infarction under conservative intensive care.// Intensive Care Med. 1998. V.24. p.620-623.
- Bijlenga P., Czosnyka M., Budohoski K.P., Soehle M., Pickard J.D., Kirkpatrick P.J., Smielewski P."Optimal cerebral perfusion pressure" in poor grade patients after subarachnoid hemorrhage.// Neurocrit Care. 2010. V.13. p.17-23.
- Bratton S.L., Davis R.L. Acute lung injury in isolated traumatic brain injury.// Neurosurg. 1997. V.40. p.707-712.
- Broderick J.P., Adams H.P. Jr., Barsan W., Feinberg W., Feldmann E., Grotta J., Kase C., Krieger D., Mayberg M., Tilley B., Zabramski J.M., Zuccarello M. Guidelines for the management of spontaneous intracerebral hemorrhage: a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association.// Stroke. 1999. V.30. p.905–915.
- Castillo J., Leira R., García M.M., Serena J., Blanco M., Dávalos A. Blood pressure decrease during the acute phase of ischemic stroke is associated with brain injury and poor stroke outcome.// Stroke. 2004. V.35. p.520-526.
- Changaris D.G., McGraw C.P., Richardson J.D., et al: Correlation of cerebral perfusion pressure and Glasgow Coma Scale to outcome.// J. Trauma. 1987. V.27. p.1007-1013.
- Contant C.F., Valadka A.B., Gopinath S.P., Hannay H.J., Robertson C.S. Adult respiratory distress syndrome: a complication of induced hypertension after severe head injury.// J. Neurosurg. 2001 V.95. p.560-568.
- Czosnyka M., Smielewski P., Kirkpatrick P., Laing R.J., Menon D., Pickard J.D. Continuous assessment of the cerebral vasomotor reactivity in head injury.// Neurosurg. 1997. V.41.p.11-17.
- Eker C., Asgeirsson B., Grände P.O., Schalén W., Nordström C.H. Improved outcome after severe head injury with a new therapy based on principles for brain volume regulation and preserved microcirculation.// Crit. Care Med. 1998. V.26. p.1881-1886.
- Fernandes H.M., Siddique S., Banister K., Chambers I., Wooldridge T., Gregson B., Mendelow A.D. Continuous monitoring of ICP and CPP following ICH and its relationship to clinical, radiological and surgical parameters.// Acta Neurochir. Suppl. 2000. V.76. p.463-466.
- Frank J.I. Large hemispheric infarction, deterioration, and intracranial pressure.// Neurology. 1995. V.45. p.1286–1290.
- Giller C.A. A bedside test for cerebral autoregulation using transcranial Doppler ultrasound.// Acta Neurochir. (Wien). 1991. V.108. p.7–14.
- Graham D.I., Ford I., Adams J.H., Doyle D., Teasdale G.M., Lawrence A.E., McLellan D.R. Ischaemic brain damage is still common in fatal non-missile head injury.// J Neurol. Neurosurg. Psychiatry. 1989. V.52. p.346-350.
- Grände P.O., Asgeirsson B., Nordström C.H. Physiologic principles for volumeregulation of a tissue enclosed in a rigid shell with application to the injured brain.// J. Trauma. 1997. V.42. p.S23-31.
- Grände P.O. The Lund concept for the treatment of patients with severe traumatic brain injury. J Neurosurg Anesthesiol. 2011;23(4):358-362.
- Guidelines for management of ischaemic stroke and transient ischaemic attack 2008.// Cerebrovasc. Dis. 2008. V.25. p.457-507.
- Guidelines for the management of severe traumatic brain injury. IX. Cerebral perfusion thresholds.// J. Neurotrauma. 2007. V.24. Suppl 1. p.59-64.
- Hacke W. Malignant” middle cerebral artery territory infarction: clinical course and prognostic signs.// Arch. Neurol. 1996. V.53. p.309–315.
- Heuer G.G., Smith M.J., Elliott J.P., Winn H.R., LeRoux P.D. Relationship between intracranial pressure and other clinical variables in patient a with aneurismal subarachnoid hemorrhage.// J. Neurosurg. 2004. V.101. p.408-416.
- Jones T.H., Morawetz R.B., Crowell R.M., Marcoux F.W., FitzGibbon S.J., DeGirolami U., Ojemann R.G. Thresholds of focal cerebral ischemia in awake monkeys.// J.Neurosurg. 1981. V.54. p.773-782.
- Laidlaw J.D., Siu K.H. Poor-grade aneurysmal subarachnoid hemorrhage: outcome after treatment with urgent surgery.// Neurosurg. 2003. V.53. p.1275-1280.
- Leonardi-Bee J., Bath P.M., Phillips S.J., Sandercock P.A. IST Collaborative Group. Blood pressure and clinical outcomes in the International Stroke Trial.// Stroke. 2002. V.33. p.1315–1320.
- Mack W.J., King R.G., Ducruet A.F., Kreiter K., Mocco J., Maghoub A., Mayer S., Connolly E.S. Jr. Intracranial pressure following aneurismal subarachnoid hemorrhage: monitoring practices and outcome data.// Neurosurg Focus. 2003. V.14. p.e3.
- Marshall L.F., Gautille T., Klauber M.R., et al. The outcome of severe closed head injury. J. Neurosurg. 1991. V.75. p.S28-S36.
- McGraw C.P. A cerebral perfusion pressure greater than 80 mm Hg is more beneficial.// In Hoff J.T., Betz A.L. (eds). Intracranial pressure VII. 1989. Berlin. Springer-Verlag. p.839-841.
- Miller J.D. Head injury and brain ischemia--implications for therapy.// Br. J. Anaesth. 1985. V.57. p.120-130.
- Mocco J., Rose J.C., Komotar R.J., Mayer S.A. Blood pressure management in patients with intracerebral and subarachnoid hemorrhage.// Neurosurg. Clin. N. Am. 2006. V.17. Suppl 1. p.25-40.
- Morgenstern L.B., Hemphill J.C. 3rd, Anderson C., Becker K. Guidelines for the management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association.// Stroke. 2010. V.41. p.2108-2129.
- Nates J.L., Niggemeyer L.E., Anderson M.B., Tuxen D.V. Cerebral perfusion pressure monitoring alert!// Crit. Care Med. 1997.V. 25.p.895–896.
- O`Rourke MF, Pauca A, Jiang XJ. Pulse wave analysis. Br. J. Clin. Pharmacol. 2001; 51: 507-522.
- Powers W.J. Acute hypertension after stroke: the scientific basis for treatment decisions. Neurology 1993; 43: 461-467.
- Qureshi A.I., Ezzeddine M.A., Nasar A., Suri M.F., Kirmani J.F., Hussein H.M., Divani A.A., Reddi A.S. Prevalence of elevated blood pressure in 563,704 adult patients with stroke presenting to the ED in the United States.// Am. J. Emerg. Med. 2007. V.25. p.32–38.
- Qureshi AI. Antihypertensive Treatment of Acute Cerebral Hemorrhage (ATACH): rationale and design.// Neurocritical Care. 2007. V.6. p.56–66.
- Robertson C.S., Valadka A.B., Hannay H.J., Contant C.F., Gopinath S.P., Cormio M., Uzura M., Grossman R.G. Prevention of secondary ischemic insults after severe head injury.// Crit. Care Med. 1999 V.27. p.2086-2095.
- Rose J.C., Mayer S.A. Optimizing blood pressure in neurological emergencies.// Neurocrit. Care. 2004. V.1. p.287-299.
- Rosner M.J., Becer D.P. The etiology of plateau waves: a theoretical model and experimental observations.// In: Ishii S., Nagai H., Brock M., (eds). Intracranial pressure V. Berlin. Spriger-Verlag: 1983. p.301-306.
- Rosner M.J., Daughton S. Cerebral perfusion pressure management in head injury.// J. Trauma. 1990. V.30. p.933-941.
- Rosner M.J., Rosner S.D., Johnson A.H. Cerebral perfusion pressure: management protocol and14 clinical results.// J. Neurosurg. 1995. V.83. p.949-962.
- Schwab S. The value of intracranial pressure monitoring in acute hemispheric stroke.// Neurology.1996. V.47. p.393–398.
- Strebel S., Lam A.M., Matta B.F., Newell D.W. Impaired cerebral autoregulation after mild brain injury.// Surg. Neurol. 1997. V.47. p.127-131.
- Vahedi K., Hofmeijer J., Juettler E., Vicaut E., George B., Algra A., Amelink G.J., Schmiedeck P., Schwab S., Rothwell P.M., Bousser M.G., van der Worp H.B., Hacke W. DECIMAL, DESTINY, and HAMLET investigators. Early decompressive surgery in malignant infarction of the middle cerebral artery: a pooled analysis of three randomised controlled trials.// Lancet Neurol. 2007. V.6. p.215-222.
- Yoshida A., Shima T., Okada Y., et al. Outcome of patients with severe head injury. Evaluation by cerebral perfusion pressure.// In Nakamura N., Hashimoto T., Yasue M. (eds). 1993. Hong Kong. Springer-Verlag. p.309-312.
- Zhang Y., Reilly K.H., Tong W., Xu T., Chen J., Bazzano L.A. Qiao D., Ju Z., Chen C.S. He J. Blood pressure and clinical outcome among patients with acute stroke in Inner Mongolia, China.// J. Hypertens. 2008. V.26. p.1446–1452.
- Ziai W.C., Torbey M.T., Naff N.J., Williams M.A., Bullock R., Marmarou A., Tuhrim S., Schmutzhard E., Pfausler B., Hanley D.F. Frequency of sustained intracranial pressure elevation during treatment of severe intraventricular hemorrhage.// Cerebrovasc. Dis. 2009. V.27. p.403-410.






