НИИ нейрохирургии им. акад. Н.Н. Бурденко
Введение
Одной из основных задач раннего послеоперационного периода при нейрохирургических вмешательствах на структурах ЗЧЯ является своевременное и безопасное прекращение ИВЛ и экстубация больного. Принятие решения о безопасной экстубации пациента после операции удаления опухолей задней черепной ямки (ЗЧЯ) основывается на оценке следующих критериев.
Восстановление бодрствования и способности отчетливого выполнения инструкций.
Восстановление адекватного самостоятельного дыхания.
Восстановление функции гортаноглотки (оценка качества глотания и необходимости протекции от аспирации).
Две первые составляющие являются универсальными для всех пациентов и подробно освещены в протоколах и рекомендациях по анестезиологии [1-4]. Оценка сохранности функции гортаноглотки, качества глотания и необходимости протекции от аспирации у интубированного пациента представляют сложность. При разных вариантах поражения ствола головного мозга выявляется весь спектр нарушений глотания. Для грубых вариантов бульбарных нарушений характерно обилие секрета в ротоглотке, истечение слюны изо рта, через наружные носовые ходы при параличе мышц мягкого неба. При выраженных нарушениях глотания больной обычно не может выдвинуть язык за линию зубов. Отсутствие кашля на введение санационного катетера свидетельствует о снижении чувствительности слизистой оболочки трахеи. При различном уровне поражения ствола головного мозга возможны нарушения открывания рта от тризма до вялого отвисания нижней челюсти. В качестве клинической оценки функции гортаноглотки мы используем алгоритм, разработанный в нашем отделении реанимации и ИТ НИИ Нейрохирургии им. Н.Н. Бурденко [5]. Данный алгоритм, используемый нами в клинической практике, позволяет с высокой вероятностью выявлять пациентов с нарушенной функцией глотания после восстановления сознания и способности пациета сотрудничать с врачом, проводящим осмотр. Недостатками теста клинической оценки готовности пациента к экстубации является его субъективный характер и невозможность его проведения в условиях поверхностной седации. Нередко у пациентов, после удаления опухолей ЗЧЯ пробуждение сопровождается психомоторным возбуждением без восстановления ясного сознания. Это сочетается с артериальной гипертензией, бурной реакцией на эндотрахеальную трубку, борьбой с респиратором, что может привести к формированию послеоперационных осложнений. В связи с этим, пациенты могут потребовать продления седации различной глубины, что делает применение теста клинической оценки готовности к экстубации невозможным. Очевидно, что у этой группы больных с опухолями ЗЧЯ необходимы вспомогательные методы оценки готовности пациента к экстубации.
В современной литературе достаточно подробно освещены вопросы, связанные с мониторингом функций ствола головного мозга методом соматосенсорных вызванных потенциалов (ССВП) во время оперативного вмешательства на ЗЧЯ с целью снижения риска его травматизации [6-12]. Исследование ССВП может проводиться на фоне седации [15,16], и не вызывает изменений параметров гемодинамики, ВЧД. Однако исследований функций ствола головного мозга методом ССВП в раннем послеоперационном периоде в доступной нам литературе не найдено.
Целью нашего исследования было выявление изменений кортикальных ответов соматосенсорных вызванных потенциалов у пациентов с нарушениями глотания после операции по удалению опухолей ЗЧЯ. В качестве теста для клинической оценки нарушений глотания мы использовали шкалу оценки нарушений глотания у интубированного пациента с повреждением ствола головного мозга. Мы провели сопоставление кортикальных ответов ССВП с результатами теста оценки нарушений глотания у интубированного пациента и клиническим результатом экстубации.
Материалы и методы исследования
В исследование были включены 17 пациентов (6 мужчин, 11 женщин) с опухолями задней черепной ямки в возрасте от 21 до 81 лет (54 ±16 лет). Морфологически опухоли распределились следующим образом: невринома слухового нерва - 9 пациентов, менингиома задней черепной ямки 7, кавернома среднего мозга 1. Опухоли локализовались преимущественно справа у 9 пациентов, слева у 7 пациентов, медианно у 1 пациента. Всем пациентам были исследованы ССВП до операции по 2 идентичных теста слева и справа. Признаком удовлетворительно проведенного исследования считалось изменение латентности и амплитуды пиков N9, N13, N20 не более чем на 5% в каждом из идентичных тестов. Повторное исследование ССВП проводилось сразу после поступления пациента в палату пробуждения отделения реанимации и ИТ после оперативного вмешательства. Фиксировалось время поступления в палату пробуждения; проводилась качественная оценка сознания пациента – ему предлагалось выполнить инструкции (пожимание рук, движения в ногах, движения головы), время, когда пациент смог их выполнить также фиксировалось. После восстановления сознания проводился неврологический осмотр. К этому времени реаниматолог оценивал клинические критерии готовности пациента к экстубации, не зная результатов ССВП, по стандартной схеме - уровень бодрствования, степень остаточной миорелаксации, качество сознания (возможность выполнять инструкции врача), сохранность стволовых рефлексов насколько это было возможно. Оценка нарушений глотания у интубированного пациента проводилась по следующей схеме:
1.Способность больного широко открывать и закрывать рот;
2.Способность глотать слюну, скапливающуюся во рту, объем движения щитовидного хряща и напряжение диафрагмы рта;
3.Наличие и объем секрета в ротоглотке;
4.Объем движений языка;
5.Реакция больного на интубационную трубку;
6.Реакция на санацию трахеи.
После клинического теста врач принимал решение о проведении экстубации трахеи или необходимости дальнейшего проведения ИВЛ и продлении седации. Фиксировалось время выполнения экстубации.
ССВП записывались прибором «Нейромиан» Медиком МТД по стандартной схеме [15]. Активные электроды располагались на скальпе в точках С'3, C'4 (примерно на 2 см кзади и на 1 см ниже стандартных отведений С3, С4 по международной схеме 10–20 %), в области VII шейного позвонка и в точке Эрба ипсилатерально стороне стимуляции. В качестве референтных электродов использовался цефалический электрод (Fz), нулевой электрод - на предплечье. Подэлектродное сопротивление не превышало 5 КОм, разница подэлектродных сопротивлений составляла не более 2 КОм. Стимуляционная колодка крепилась в проекции n. medianus на запястье. Параметры стимуляции: длительность стимула 0,1 мс, сила стимула от 9 до 18 мА, а критериями адекватной стимуляции считалось движение большого пальца, частота стимуляции 5,1 Гц, эпоха анализа 50 мс, порог режекции не превышал 60 мВ. Число усреднений n=2000-4000.
Выделялись типичные компоненты ССВП на скальповом (на стороне конталатеральной стимуляции n.medianus) (N20, P23), шейном (N13) и периферическом (N9) уровнях, с последующим анализом абсолютных латентностей компонентов N20 и N13, межпикового интервала (МПИ) N13-N20, который отражает центральное время проведения и амплитуды компонента N20. Значения выше указанных параметров заносились в индивидуальные электронные таблицы и затем выбирались лучшие значения показателей. Анализ абсолютных и среднестатистических значений временных и амплитудных параметров компонентов ССВП не позволяет однозначно интерпретировать полученные данные. Нами был разработан индекс асимметрии ответов (ИАО), который является относительным показателем, суть которого заключается в сравнении значения латентностей компонентов N13 и N20, МПИ N13-N20 и амплитуды компонента N20, зарегистрированных при стимуляции n.medianus dex и n.medianus sin. Индекс вычислялся по формуле |x-y/(x+y)|, где x - значение соответствующего параметра при правосторонней стимуляции, y - значение аналогичного параметра при левосторонной стимуляции. Модуль исключает ошибки, связанные с возможностью получения отрицательных показателей при расчете среднего у противоположных по знаку значений. Значения ИАО, близкие к нулю, указвают на симметричность ответов ССВП, полученных при стимуляции n.medianus с разных сторон. Значения ИАО, близкие к единице указывают на выраженную ассиметрию ответов между сторонами стимуляции, что является важным показателем отклонений [15]. Индекс асимметрии ответов вычислялся для всех указанных параметров до и после операции. Статистическая обработка данных производилась в программе Statistika 7.
Анализ результатов и их обсуждение
Ни у одного из пациентов в дооперационном периоде по данным ССВП не выявлено увеличения абсолютных латентностей компонентов N13 и N20, выходящих за пределы референсных значений, абсолютные латентности данных компонентов при стимуляции справа и слева статистически значимо не различались. Центральное время проведения у всех пациентов в дооперационном периоде не превышало 7,15 мс (в среднем 5,78 мс) и статистически значимо не различалось при стимуляции справа и слева (p=0,19). Вариабельность амплитуды пика N20 составила от 0,15 до 2,43 мкВ.
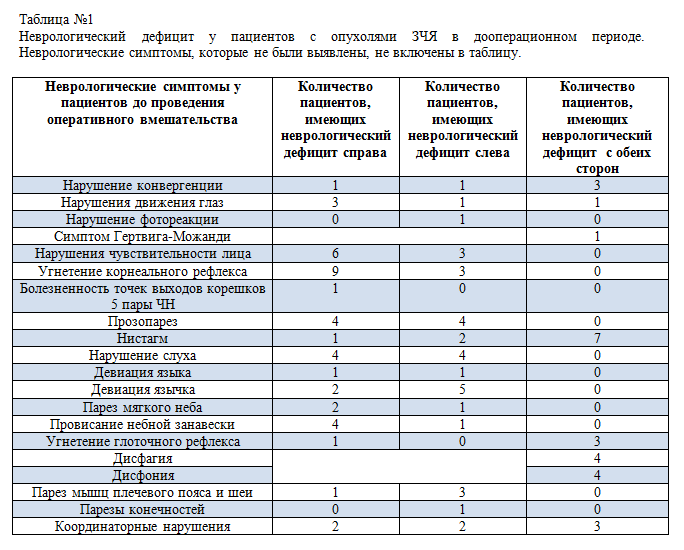
16 пациентов, вошедших в исследование до оперативного вмешательства, были в ясном сознании, 1 - в легком оглушении, 13 пациентов могли самостоятельное передвигаться и обследовались в условиях лаборатории, 4 были обследованы в палате хирургического отделения. Все 17 пациентов имели очаговый неврологический дефицит различной степени выраженности, обусловленный опухолью задней черепной ямки (таблица №1). Опухоли и их локализации были достоверно идентифицированы по результатам МРТ, интраоперационно, и по результатам биопсии. Ни у одного из пациентов опухоли не инфильтрировали ствол головного мозга, а только компримировали его в той или иной степени.
Рисунок №1
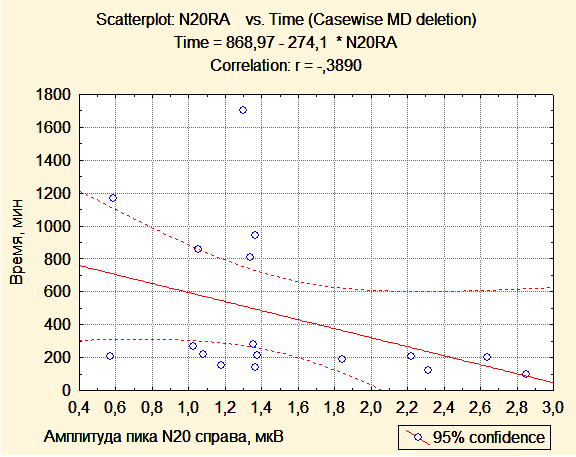
Рисунок №2
В зависимости от длительности проведения ИВЛ в раннем послеоперационном периоде пациенты разделились на 2 группы. Первая группа состояла из 12 пациентов. Все они в раннем послеоперационном периоде открыли глаза, выполненили инструкции врача и были успешно экстубированы в среднем в течение 4,6 часов. Ни у одного из пациентов в этой группе не было необходимости в реинтубации и не было выявлено нарушений функции черепных нервов бульбарной группы. В целом нарастания очаговой неврологической симптоматики по сравнению с таковой в дооперационном периоде не отмечалось. Вторая группа состояла из 6 пациентов, 5 из которых в раннем послеоперационном периоде открыли глаза и выполнили инструкции врача и были экстубированы в среднем через 15 часов после операции, а у одного выполнена трахеостомия в связи с многократными неудачными клиническими тестами готовности к экстубации. При наличии отчетливых признаков пробуждения и выполнения инструкций эти пациенты не смогли пройти клинический тест готовности к экстубации. В связи с этим у них проводилась медикаментозная седация и ИВЛ с периодическим пробуждением и повторением клинического теста готовности к экстубации. Один пациент пробудился, но был грубо дезориентирован, инструкции не выполнил и был экстубирован через 19 часов после поступления в палату пробуждения без нарушений глотания, но с выраженными мнестическими нарушениями, которые регрессировали в течение следующих суток. Ни в одной из групп у пациентов по данным исследования ССВП не обнаружено увеличения абсолютной латентности пиков N13 и N20, выходящих за пределы референсных значений, ни у одного пациента данный параметр не имел статистически значимых различий при стимуляции справа и слева.
Рисунок №3
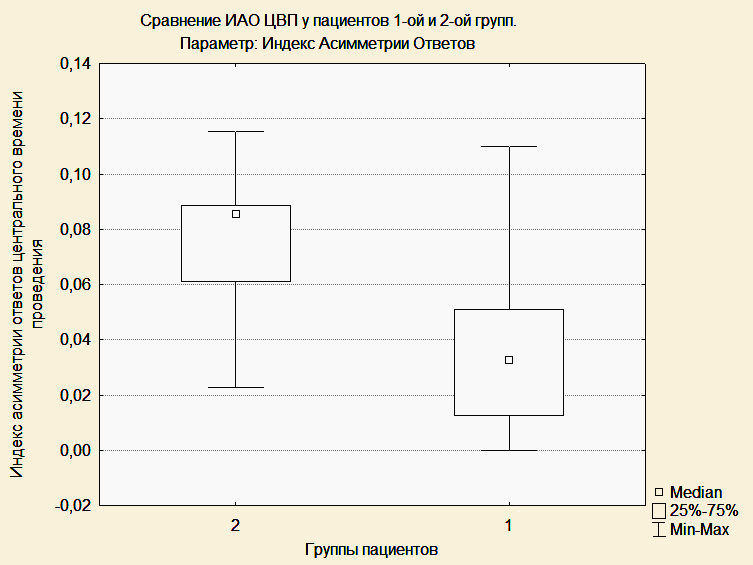
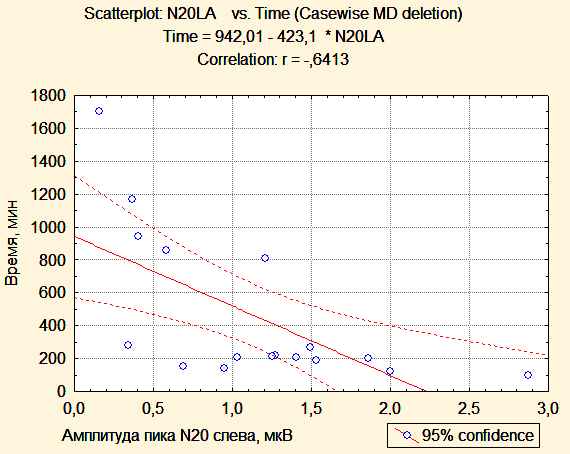
Индекс асимметрии ответов центрального времени проведения после операции был статистически значимо меньше в первой группе, чем во второй (0,0376 и 0,0747, p=0,04). Таким образом, у пациентов второй группы значения ЦВП (МПИ N13-N20) были симметричны при стимуляции справа и слева, а у пациентов первой группы наблюдалась асимметрия центрального времени проведения за счет одностороннего увеличения латентности компонента N20. Получена статистически значимая обратная корреляция между величиной амплитуды кортикального ответа N20 на стороне опухоли и временем, прошедшим с момента поступления пациента в палату пробуждения до момента экстубации (r=0,5; r=0.6; p<0,05). У пациента, которому впоследствии была выполнена трахеостомия, пик N20 отсутсвовал на стороне опухоли.
Дискуссия
Соматосенсорные вызванные потенциалы (ССВП) - электрические потенциалы, генерируемые различными частями восходящего пути глубокой проприоцептивной чувствительности в ответ на стимуляцию периферических нервов [15]. Известно, что изменение латентности компонентов ССВП свидетельствует о нарушении функции шванновских клеток [17] и косвенно говорит об ишемии участков ствола и полушарий головного мозга, в которых проходят пути глубокой проприоцептивной чувствительности (ГПЧ), либо о демиелинизирующем поражении оболочек нервных отростков, что встречается при рассеянном склерозе. В нашем исследовании не было пациентов, у которых в дооперационном периоде выявлялось увеличение латентности кортикальных ответов. Это косвенно подтверждает экзофитный характер роста опухолей у исследуемых пациентов и отсутствие ишемического поражения участков ствола головного мозга, в которых проходят пути глубокой проприоцептивной чувствительности в дооперационном периоде. В работе, где исследовались пациенты с опухолями, инфильтрирующими ствол головного мозга, показано, что изменение кортикальных ответов ССВП происходит в первую очередь за счет увеличения абсолютной латентности N20 [18].
Снижение амплитуды ответов ССВП может соответствовать уменьшению пула аксонов в пучке проводящих путей ГПЧ [17]. Таким образом, снижение амплитуды кортикальных ответов ССВП без изменения их латентности может быть обусловлено прямым повреждением волокон во время вмешательства. С другой стороны, учитывая локализацию этих путей и недопустимость столь агрессивного воздействия на ствол головного мозга во время хирургического вмешательства, предположение о прямом повреждении путей ГПЧ абсурдно. Что же тогда вызывает снижение амплитуды кортикальных ответов без увеличения абсолютной латентности? Можно предположить, что изменение амплитуды компонета N20 связано с отеком структур мозга, где проходят пути ГПЧ. Этот отек может быть вызван как воздействием опухоли, так и результатом хирургических манипуляций во время операции. По результатам нашей работы выявлено увеличение межпикового интервала N13-N20 (центральное время проведения) в группе пациентов, которым потребовалось продление ИВЛ, по сравнению с теми, которые были экстубированы после восстановления сознания. По данным изученной литературы увеличение МПИ без уменьшения амплитуды пиков – частое и, обычно, обратимое явление, которое наблюдается при дисфункции ствола на фоне применения препаратов, метаболических расстройств и гипотермии [16]. В нашем случае увеличение центрального времени проведения происходило на фоне уменьшения амплитуды компонетна N20. Статистически подтвердить эту связь невозможно по причине малой выборки, но, предположительно, это могло быть связано с ишемическим процессом в стволе головного мозга.
Глубокая пропироцептивная чувствительность (ГПЧ) является осознанной и включает в себя мышечно-суставное чувство, чувство давления, вибрации и кинестезии. Пути ГПЧ от верхних и нижних конечностей, прерываясь в клиновидном и тонком ядрах, следуют к передне-центральным отделам и занимают самую глубокую часть передней борозды, образовавшейся между оливами сверху и валиками пирамидных путей снизу. Перекрест lemniscus medialis происходит в верхних 2/3 продолговатого мозга и продолжается в нижних отделах моста. Далее пути ГПЧ проходят в передней части покрышки моста. В покрышке среднего мозга они сгруппированы в её переднем отделе, по поперечнику локализуюсь в центрально латеральных отделах от красных ядер, вдоль черной субстанции [20].
Афферентные волокна глубокой проприоцептивной чувствительности от головы, шеи, языка и глотки описаны в составе 9 и 10 пары ЧН. Аксоны 2 нейронов путей ГПЧ следуют в перекрест медиальной петли и направляются в таламус вместе с аксонами вторых нейронов от ядер Бурдоха и Голля.
Можно предположить, что при нарушении проведения импульсов от верхних конечностей по путям ГПЧ (в результате отека ствола головного мозга на уровне медиальной петли) также происходит нарушение проведения по путям ГПЧ от слизистой языка и глотки, поскольку они проходят в едином пучке нервных волокон. На основании этого можно допустить, что изменение кортикальных ответов N20 ССВП при стимуляции верхних конечностей будет косвенно свидетельствовать о нарушении проведения ГПЧ от мышц языка и глотки, при условии, что повреждение ствола головного мозга произошло выше, чем афферентные проводники ГПЧ IX и X пар ЧН вошли в состав медиальной петли, или нарушение проведения по проводникам ГПЧ произошло выше вступления их в таламус.
Характер изменений ССВП в раннем периоде после операции на структурах ЗЧЯ позволяет предположить связь между снижением амплитуды компонента N20 и асимметричностью центрального времени проведения с нарушением глубокой чувствительности корня языка и задней стенки глотки. Следует заметить, однако, что отсутствие снижения амплитуды кортикальных ответов N20 ССВП не могут быть надежным предиктором нарушения глотания у пациента в раннем послеоперационном периоде после операций на структурах ЗЧЯ. Нарушение глубокой чувствительности корня языка и задней стенки глотки, и, как следствие, нарушения акта глотания, является одной из причин неудачной экстубации пациентов после операций на структурах ЗЧЯ.
Таким образом, врач, принимающий решение об экстубации пациента после операции на ЗЧЯ, должен учитывать результаты клинических и инструментальных тестов, оценивающих риск нарушений глотания. Одним из таких исследований может служить уменьшение амплитуды кортикальных ответов N20 ССВП и ассиметричность центрального времени проведения при условии отсутствия повреждения таламуса и коры головного мозга.
Учитывая большое количество допущений, на малой выборке пациентов, полученные данные являются предметом дискуссии и позволяют продолжить исследование в данном направлении.
Выводы
1.Асимметричность центрального времени проведения при стимуляции справа и слева и снижение амплитуды пика N20 на стороне опухоли могут служить дополнительным предиктором нарушения глотания у пациента при условии отсутствия повреждения таламуса и коры головного мозга.
2.Стойкое отсутствие кортикальных ответов с одной стороны после операции на ЗЧЯ может служить дополнительным показанием в пользу необходимости протекции дыхательных путей, продленной ИВЛ и в дальнейшем принятии решения о необходимости ранней трахеостомии при условии отсутствия повреждения таламуса и коры головного мозга.
Список литературы
1.Дж. Эдвард Морган мл., Мэгид С. Михаил. Клиническая анестезиология. Книга первая. Издательство: Бином, 2008 г.
2.Практическое руководство по анестезиологии /Под ред. В.В. Лихванцева. — М.: Медицинское информационное агентство, 1998 г.
3.Эйткенхед А.Р., Смит Г., "Руководство по анестезиологиии" в 2-х томах (под. ред.) перевод Дудникова С.Ф., М. Медицина 1999 г.
4.Пол Д. Барах, Брюс Ф. Куллен, Роберт К. Стэлтинг; Клиническая анестезиология. М. 2007 г.
5.Горячев А.С., Савин И.А., Пуцилло М.В., Брагина Н.Н., Соколова Е.Ю., Щепетков А.Н., Фокин М.С., Кроптова М.В. Шкала оценки и терапевтическая стратегия при нарушении глотания у больных с повреждением ствола головного мозга. Вопросы нейрохирургии №4 2006 стр. 24-28.
6.Nuwer MR, Daube J, Fischer C, Schramm J, Yingling CD. Neuromonitoring during surgery. Report of an IFCN Committee. Electroencephalogr Clin Neurophysiol. 1993 Nov;87(5):263-76.
7.Schekutiev G.A., Lazarev V.A., Tchurilov M.V. Somatosensory evoked potential in intracranial aneurysm surgery with endovascular occlusion.// Selected abstracts of 4th Internat. Symposium "CNS Monitoring", Gmunden, Austria, 1996./ J.Neurosurg. Anesth., 1997, V.9, N.1, p.94.
8.Щекутьев Г.А. Нейромониторинг: современное состояние и перспективы развития.// Ж.Высшей Нервной Деятельности, 1998, Т.48, в.4, с.747-756.
9.Manninen PH, Patterson S, Lam AM, Gelb AW, Nantau WE. Evoked potential monitoring during posterior fossa aneurysm surgery: a comparison of two modalities. Can J Anaesth. 1994 Feb;41(2):92-7.
10.Georg Neuloh, M.D., And Johannes Schramm, M.D. Klinik und Poliklinik fur Neurochirurgie, Rheinische Friedrich-Wilhelms-Universitat, Bonn,; Monitoring of motor evoked potentials compared with somatosensory evoked potentials and microvascular Doppler ultrasonography in cerebral aneurysm surgery. J Neurosurg 100:389–399, 2004
11.Kang De-Zhi, Wu Zan-Yi, Lan Qing, Yu Liang-Hong, Lin Zhang-Ya, Wang Chen-Yang and Lin Yuan-xiang Combined monitoring of evoked potentials during microsurgery for lesions adjacent to the brainstem and intracranial aneurysms Chinese Medical Journal 2007; 120(18):1567-1573
12.Robert H. Wilkins, M.D., Rodney A. Radtke, M.D., and C. William Erwin, M.D. Value of lntraoperative Brainstemn Auditory Evoked Potential Monitoring in Reducing the Auditory Morbidity Associated with Microvascular Decompression of Cranial Nerves. Skull Base Surgery, Volume 1, Number 2, April 1991
13.William A. Friedman, M.D., Barry J. Kaplan, M.D., Dietrich Gravenstein, B.S., and Albert l. Rhoton, jr., M.D. Intraoperative brain-stem auditory evoked potentials during posterior fossa microvascular decompression. J Neurosurg 62:552-557, 1985
14.Samuel H. Selesnick, M.D., and Daniel F Goldsmith. Issues in the Optimal Selection of a Cranial Nerve Monitoring System Skull Base Surgeryn volume 3, number 4 october 1993.
15.Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. МЕДпресс-информ. 2003
16.J.-M. Guérit, A. Amantini, P. Amodio, K. V. Andersen, S. Butler, A. de Weerd, E. Facco, C. Fischer, P. Hantson, V. Jäntti, M.-D. Lamblin, G. Litscherhttp Consensus on the use of neurophysiological tests in the intensive care unit (ICU): Electroencephalogram (EEG), evoked potentials (EP), and electroneuromyography (ENMG). Neurophysiologie Clinique-clinical Neurophysiology - NEUROPHYSIOL CLIN , vol. 39, no. 2, pp. 71-83, 2009
17.Robert B. Daroff, MD, Gerald M Fenichel, MD, Joseph Jankovic, MD, and John C. Mazziotta, MD, PhD Bradley's Neurology in Clinical Practice, 2-Volume Set, 6th Edition. Elsevier 2012.
18.Masafumi Fukuda, Shigeki Kameyama, Yoshiho Honda, Hidetoshi Yamazaki, Tadashi Kawaguchi, Akira Tamura,Kenji Suzuki, and Ryuichi Tanaka. Short-latency Somatosensory Evoked Potentials in Patients with Brain Stem Tumor: Study of N20 and N18 potentials. Neuro Med Chir (Tokyo) 37, 525-532, 1997.
19.Thorn Yamada, MD, Tetsuro Ishida, MD, Yutaka Kudo, MD, Robert L. Rodnitzky, MD and Jun Kimura, MD Clinical correlates of abnormal P14 in median SEPs Neurology June 1986 36:765
20.M. Baehr, M. Frotscher. Duus' Topical Diagnosis in Neurology: Anatomy, Physiology, Signs, Symptoms 4ts Completely revised edition. Thieme Stuttgart – New York 2005.






