ФГБНУ НИИ нейрохирургии им. акад. Н.Н. Бурденко
Резюме
В представленном клиническом наблюдении иллюстрируется роль скрининга маркеров воспаления и расширенного гемодинамического мониторинга в оптимизации интенсивной терапии пациента в остром периоде тяжелой черепно-мозговой травмы . Пациент поступил в отделение реанимации с диагнозом: «Острая тяжелая закрытая сочетанная черепно-мозговая травма». При поступлении уровень сознания оценивался по ШКГ 5 баллов. С первых суток пребывания в реанимации у пострадавшего отмечались гипертермия до 39,0º С, повышение С реактивного белка, лейкоцитоз, рентгенологические признаки аспирационной пневмонии. На вторые сутки для поддержания срАД не ниже 80 мм рт ст потребовалась инфузия норадреналина. На 10-е сутки состояние больного резко ухудшилось. Развилась гипертермия до 40,2º С, развилась сердечно-сосудистая недостаточность (на фоне вазопрессорной поддержки возникло резкое снижение АД до 49/20 мм рт ст). Начат расширенный гемодинамический мониторинг PiCCO (транспульмонарная термодилюция). Возникла необходимость ранней диагностики сепсиса. Стандартно используемые в работе отделения лабораторные исследования не соответствовали критериям септического шока. Отмечалось незначительное повышение CRP, а прокальциотонин (PCT) был в пределах нормальных величин. Диагностический поиск был дополнен исследованием интерлейкинов (IL-6 и IL-2R) в плазме крови. Было выявлено значительное повышение их значений, что можно было расценивать как начальные проявления системной воспалительной реакции. В результате состояние пациента было расценено как септическое. Была расширена антибактериальная терапия, начата продленная вено-венозная гемофильтрация. На фоне проводимой терапии состояние пациента стабилизировалось, у пациента восстановилось сознание в виде открывания глаз, выполнения простых инструкций. К моменту выписки состояние пациента по шкале исходов Глазго оценивалось в 4 балла.
Введение
Снижение артериального давления (АД) является ведущим фактором вторичного повреждения головного мозга у пациентов с тяжелой черепно-мозговой травмой (тЧМТ). Артериальная гипотензия (АГ) у пациентов с повышенным внутричерепным давлением (ВЧД) приводит к снижению церебрального перфузионного давления (ЦПД), что может привести к вторичной ишемии мозга. АГ требует незамедлительной коррекции, с учетом механизма её развития [1, 2,3]. В представленном клиническом наблюдении, у пациента с тЧМТ, осложнившейся септическим шоком, иллюстрируется роль расширенного гемодинамического мониторинга и скрининга маркеров воспаления в оптимизации интенсивной терапии (ИТ).
Клиническое наблюдение
Пациент К., 42 года поступил в отделение реанимации Института нейрохирургии с диагнозом: «Острая тяжелая закрытая сочетанная черепно-мозговая травма, острая субдуральная гематома в правой лобно-теменно-височной области, ушиб головного мозга средней степени, травматическое субарахноидальное кровоизлияние, перелом чешуи височной кости слева; перелом левой ключицы». При поступлении уровень сознания оценивался по ШКГ 5 баллов. В ответ на болевой стимул отмечалось приведение в руках, разгибание в ногах, анизокория D>S, фотореакция вялая, кашлевой рефлекс угнетен. По данным компьютерной томографии головного мозга: справа в лобно-височно-теменной области определялась субдуральная гематома, срединные структуры смещены влево, желудочковая система и охватывающая цистерна компримированы. Также выявлялись признаки САК и перелом чешуи височной кости слева (рис.1).
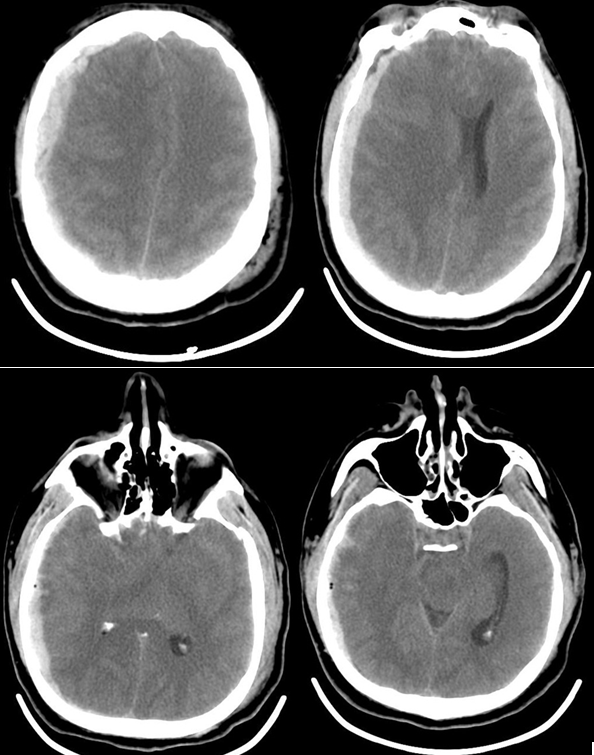
Рис. 1 КТ головного мозга пациента К., 42 года
Катетеризирована лучевая артерия, начат инвазивный мониторинг АД (монитор - Philips IntelliVue MP60). Системное АД без вазопрессорной и инотропной поддержки состовляло: АД – 145/88-160/90 мм рт.ст., ЧСС- 69-85 уд/мин. Дыхание аппаратное в режиме SIMV+PS, с параметрами вентиляции: tV- 0.7 l, RR-14, PS- 14 mbar, PEEP- 7 mbar, FiO2- 0.6, обеспечивающими нормовентиляцию по данным КОС артериальной крови. При фибробронхоскопии - признаки перенесенной аспирации.
После выполнения первичного диагностического поиска, было принято решение о хирургическом вмешательстве и выполнена «декомпрессивная трепанация черепа в правой лобно-теменно-височной области с удалением субдуральной гематомы». Операция была завершена установкой в премоторной области справа паренхиматозного датчика фирмы Codman для мониторинга ВЧД и контроля ЦПД (ЦПД=АДср-ВЧД). В течение последующих 10 суток, на протяжении всего острого периода, отмечались неоднократные подъемы ВЧД, максимально до 27 ммрт.ст., которые корректировали использованием гиперосмолярных растворов, углублением седации и обезболивания.
С первых суток пребывания в Институте у пострадавшего отмечались гипертермия до 39,0º С, повышение С реактивного белка до 125 мг/л, лейкоцитоз- 22.89 х 10 000000000/л (норма- <5 мг/л и 4.0-10.0 х 10 000000000/л соответственно) со сдвигом лейкоцитарной формулы влево, рентгенологические признаки аспирационной пневмонии (рис. 2).

Рис. 2 Рентгенограмма органов грудной полости пациента К., 42 года
На вторые сутки для поддержания срАД не ниже 80 мм рт ст потребовалась инфузия норадреналина в дозе 0,1-1,3 мкг/кг/мин.
На фоне проводимой терапии к девятым суткам отмечалась стабилизация состояния пациента, при сохраняющейся умеренной гипертермии, снизился С реактивный белок до 33 мг/л; для поддержания гемодинамики требовались меньшие дозы норадреналина (0,22 мкг/кг/мин).
На 10-е сутки состояние больного резко ухудшилось. Развилась гипертермия до 40,2º С, выраженная десатурация капиллярной крови до 81-84%, при фракции кислорода во вдыхаемой смеси 100% (FiO2-1,0). Развилась сердечно-сосудистая недостаточность: несмотря на продолжающуюся постоянную инфузию норадреналина возникло резкое снижение АД до 49/20 мм рт ст. Для поддержания адекватного среднего АД (80 мм рт.ст) потребовалась комбинация симпатомиметиков: мезатон - 5,7 мкг/кг/мин и норадреналин в дозе 1,4 мкг/кг/мин. Также развилось нарушение деятельности желудочно-кишечного тракта: энтерально вводимая питательная смесь не усваивалась, сформировался пареза кишечника. В этот период ауторегуляция мозгового кровотока была сохранна, поэтому на фоне артериальной гипотензии, снижения ЦПД, увеличилось кровенаполнение мозга, развилась внутричерепная гипертензия, с эпизодами подъема ВЧД до 40 ммрт ст. В этой ситуации было необходимо провести дифференциальную диагностику между сепсисом, формированием диэнцефального синдрома, вторичной надпочечниковой недостаточностью, и первичным повреждением миокарда. Результаты ЭХО КГ не выявили перегрузку левых и правых отделов сердца, сократительная способность миокарда не была нарушена. С целью расширения гемодинамического мониторинга была использована методика PiCCO, с помощью монитора Philips IntelliVue MP60, в который интегрированы соответствующие блоки и программы. Калибровка проводилась каждые 6-8 часов введением 15 мл изотонического раствора NaCl, охлажденного до 8о С. Оценивали: показатели работы сердца - ударный объем (УО), сердечный выброс (СВ), сердечный индекс (СИ), общую фракцию изгнания (ОФИ); преднагрузку – ОПСС; волюметрические показатели- индекс общего конечно-диастолического объема сердца (ИОКДО), индекс внутригрудного объема крови (ИВГОК), индекс экстраваскулярной легочной жидкости (ИЭВЛЖ), индекс проницаемости легочных капилляров (ИПЛК), а также вариабельность ударного объема (ВУО) – как динамический показатель эффективности инфузионной терапии. Для оценки периферического кровотока использовался также индекс перфузии (ИП), который рассчитывается исходя из анализа плетизмографической волны. Дозы симпатомиметических препаратов подбирались с учетом данных, получаемых в результате расширенного мониторинга параметров системной гемодинамики.
При исследовании гормонального профиля был исключен клинически значимый дефицит кортизола, тиреоидных гормонов, АКТГ в плазме крови. Стандартно используемые в работе отделения лабораторные исследования не соответствовали критериям септического шока. Так, отмечалось незначительное повышение CRP, а прокальциотонин (PCT) был в пределах нормальных величин, при умеренно выраженном лейкоцитозе (13х109, без сдвига лейкоцитарной формулы влево). Диагностический поиск был дополнен исследованием интерлейкинов (IL-6 и IL-2R) в плазме крови. Было выявлено значительное повышение их значений >6000 пг/мл и 2805 Е/мл (норма: 0.0-5.9 пг/мл и 158-623 Е/мл соответственно), что можно было расценивать как начальные проявления системной воспалительной реакции.
В результате состояние пациента было расценено как септическое. Была расширена антибактериальная терапия, начата продленная вено-венозная гемофильтрация (ПВВФ). Взяты биологические среды на микробиологический анализ (на вторые сутки культивирования был выявлен рост Грамм (-) возбудителя в посевах крови).
На фоне проводимой терапии состояние пациента стабилизировалось: удалось корректировать артериальную гипотензию, добиться необходимого ЦПД, что привело к нормализации ВЧД. В течение последующих двух суток, температура тела нормализовалась до 36,0º С, удалось уменьшить дозы симпатомиметиков в 2-3 раза, снизить FiO2 c 1.0 до 0.6, у пациента восстановилось сознание в виде открывания глаз, выполнения простых инструкций. На момент перевода пациента из Институте в реабилитационный центр оценка по ШИГ – 4 балла.
Обсуждение
В представленном клиническом наблюдении иллюстрируется роль скрининга маркеров воспаления и расширенного гемодинамического мониторинга в оптимизации ИТ пациента в остром периоде т ЧМТ. Бактериальные инфекции и сепсис являются основной причиной заболеваемости и смертности в ОРИТ [4, 5]. Не вызывает сомнений тот факт, что высокая смертность от сепсиса во многом обусловлена его поздней диагностикой и неэффективным мониторингом проводимого лечения. Клинические и лабораторные признаки системной воспалительной реакции, такие как лихорадка, тахикардия, тахипноэ и лейкоцитоз, могут быть результатом неинфекционных причин. С этих позиций особый интерес представляет поиск надежных и ранних маркеров системной воспалительной реакции. Если сравнивать чувствительность таких маркеров септической реакции как CRP (Ц-реактивный протеин), PCT (прокальцитонин) и IL-6 (интерлейкин-6), то по данным мировой литературы большинство авторов ставят на первое место прокальцитонин, далее интерлейкины и затем С-реактивный белок [6, 7]. Но, необходимо понимать, что в каждом конкретном случае нужно комплексно оценивать степень выраженности инфекционного процесса и его локализацию. В литературе описаны случаи, когда концентрация прокальцитонина не возрастала или возрастала в малой степени при тяжелых вирусных инфекциях или воспалительной реакции неинфекционной природы. [8, 9]. Также, доказано, что прокальцитонин не определяется или его уровень очень низок при изолированной пневмонии, но чрезвычайно высок при пневмонии и сепсисе. Что касается IL-6 – большинство авторов ставят его на второе место после прокальцитонина по чувствительности и специфичности в диагностике сепсиса. В приведенном клиническом наблюдении на 10-е сутки состояние больного резко ухудшилось, развилась сердечно-сосудистая недостаточность, артериальная гипотензия, резистентная к стандартным дозам симпатомиметических препаратов, в сочетании с выраженной устойчивой гипертемией. Артериальная гипотензия, снижение ЦПД, сочетались с эпизодами подъема ВЧД до 40 ммрт ст. В этой клинической ситуации была необходима экстренная дифференцировка между сепсисом, формированием диэнцефального синдрома, вторичной надпочечниковой недостаточностью, и первичным повреждением миокарда.
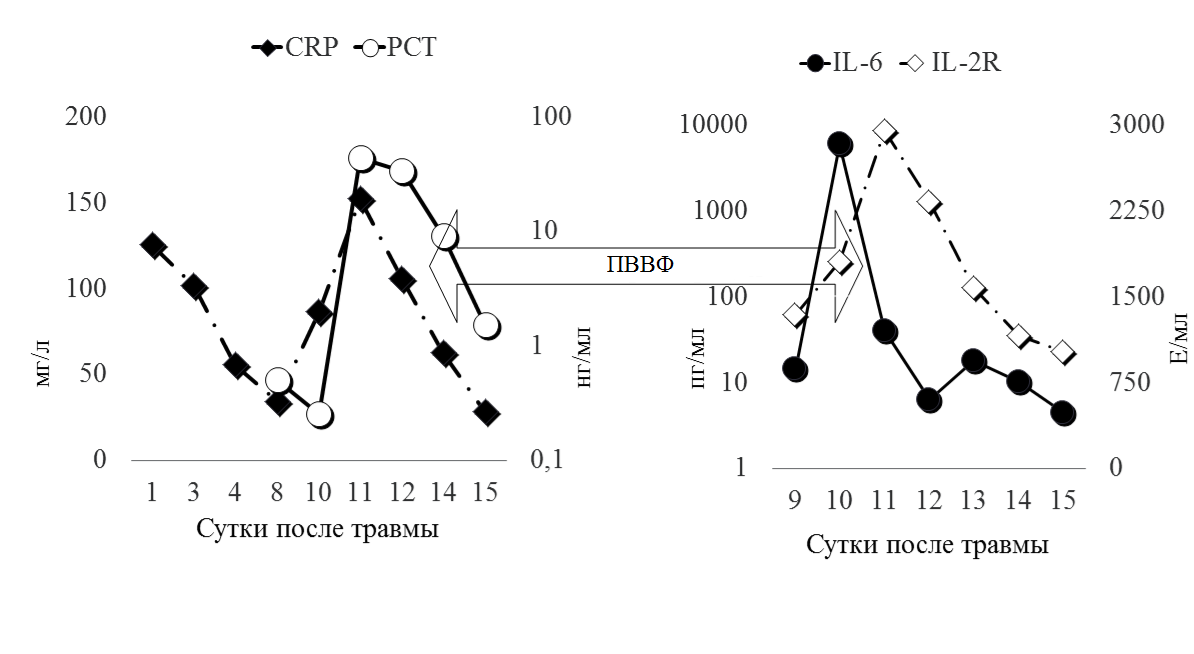
Рис. 3 Динамика маркеров воспаления
Представленный на рисунке 3 график демонстрирует отсроченную реакцию CRP и РСТ на манифестацию инфекционного процесса, их повышение отмечалось лишь через 48 часов, от развития клиники септического шока, тогда как интерлейкины, незамедлительно отреагировали на септицемию. График также демонстрирует эффективность ПВВФ в элиминации провоспалительных цитокинов из плазмы крови.
При яркой клинической картине сепсиса не было получено его подтверждения «стандартными» лабораторными методами (PCT, CRP, лейкоцитарная формула). Диагностический поиск был незамедлительно дополнен исследованием интерлейкинов, что позволило сократить время до начала патогенетической терапии. У данного пациента, именно IL-6, оказался наиболее быстрым и информативным показателем развития и выраженности септического процесса. Приводимое клиническое наблюдение наглядно демонстрирует необходимость всесторонней оценки инфекционного процесса. Все это говорит о необходимости проводить дальнейшие исследования по сравнению чувствительности различных маркеров системной воспалительной реакции и сепсиса.
Необходимо отдельно остановиться на состоянии системной гемодинамики.
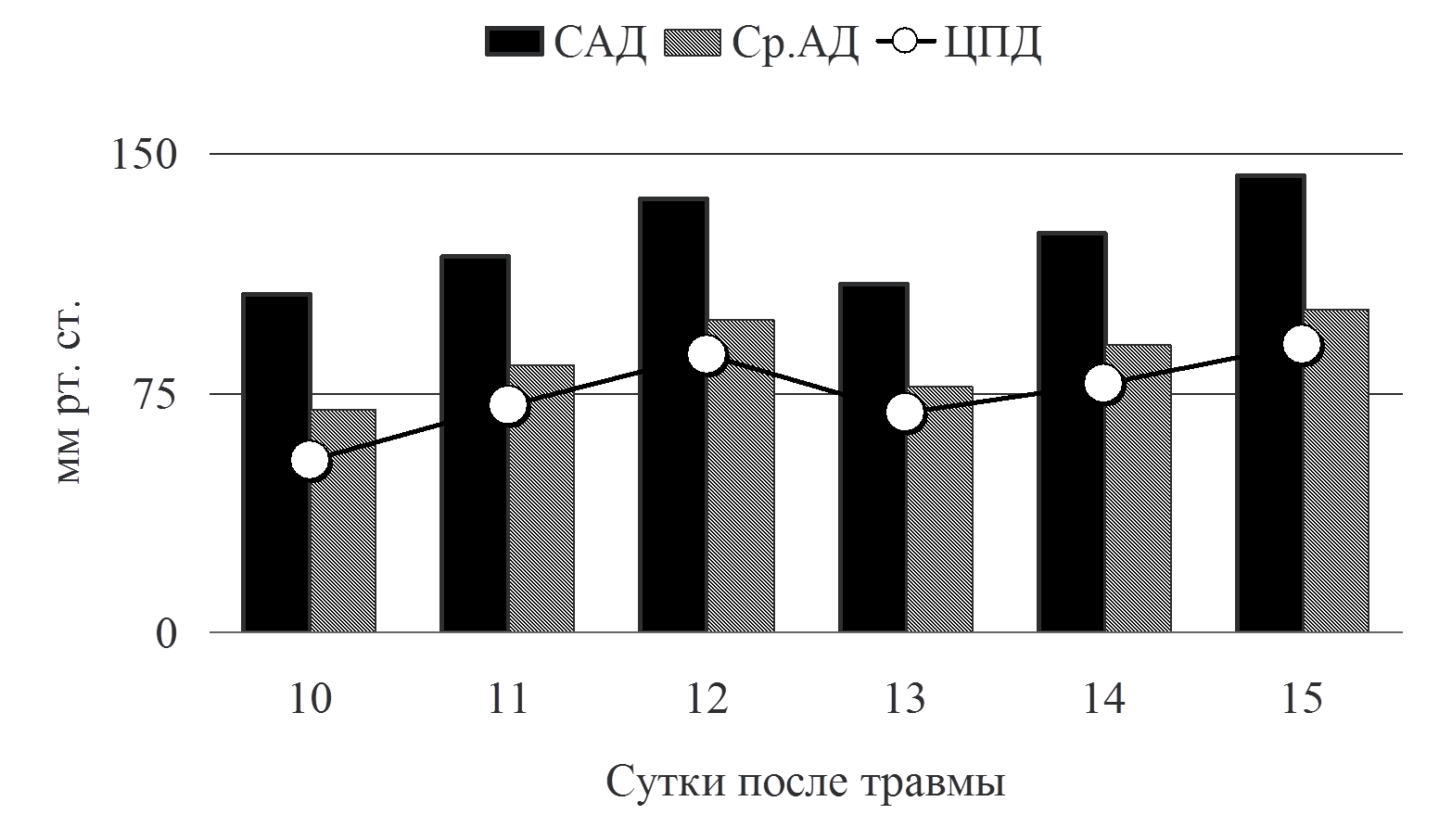
Рис.4 Динамика давления
Как видно из графика на рис. 4, мы поддерживали систолическое и среднее АД на достаточно высоких цифрах, что противоречит современным рекомендациям по терапии сепсиса. Тому есть свое объяснение. Последние международные рекомендации по ведению пациентов с тЧМТ подчеркивают необходимость мониторинга АД и предупреждения артериальной гипотензии. При этом артериальной гипотензией считается снижение систолического артериального давления ниже 90 мм рт. ст. (рекомендации второго уровня). Там же приводятся данные демонстрирующие ухудшение результатов лечения при снижении Ср. АД ниже 80 мм рт ст [10]. Высокие цифры среднего АД, обеспечивали ЦПД выше 60 мм рт. ст., что было необходимо для поддержания адекватного объемного мозгового кровотока, у пациента в остром периоде тЧМТ, осложненной отеком мозга. Как же поддерживались необходимые параметры системной гемодинамики в анализируемом клиническом наблюдении? Адекватность терапии, направленной на поддержание необходимого артериального давления, обеспечивалась расширенным гемодинамическим мониторингом PiCCO (транспульмонарная термодилюция).
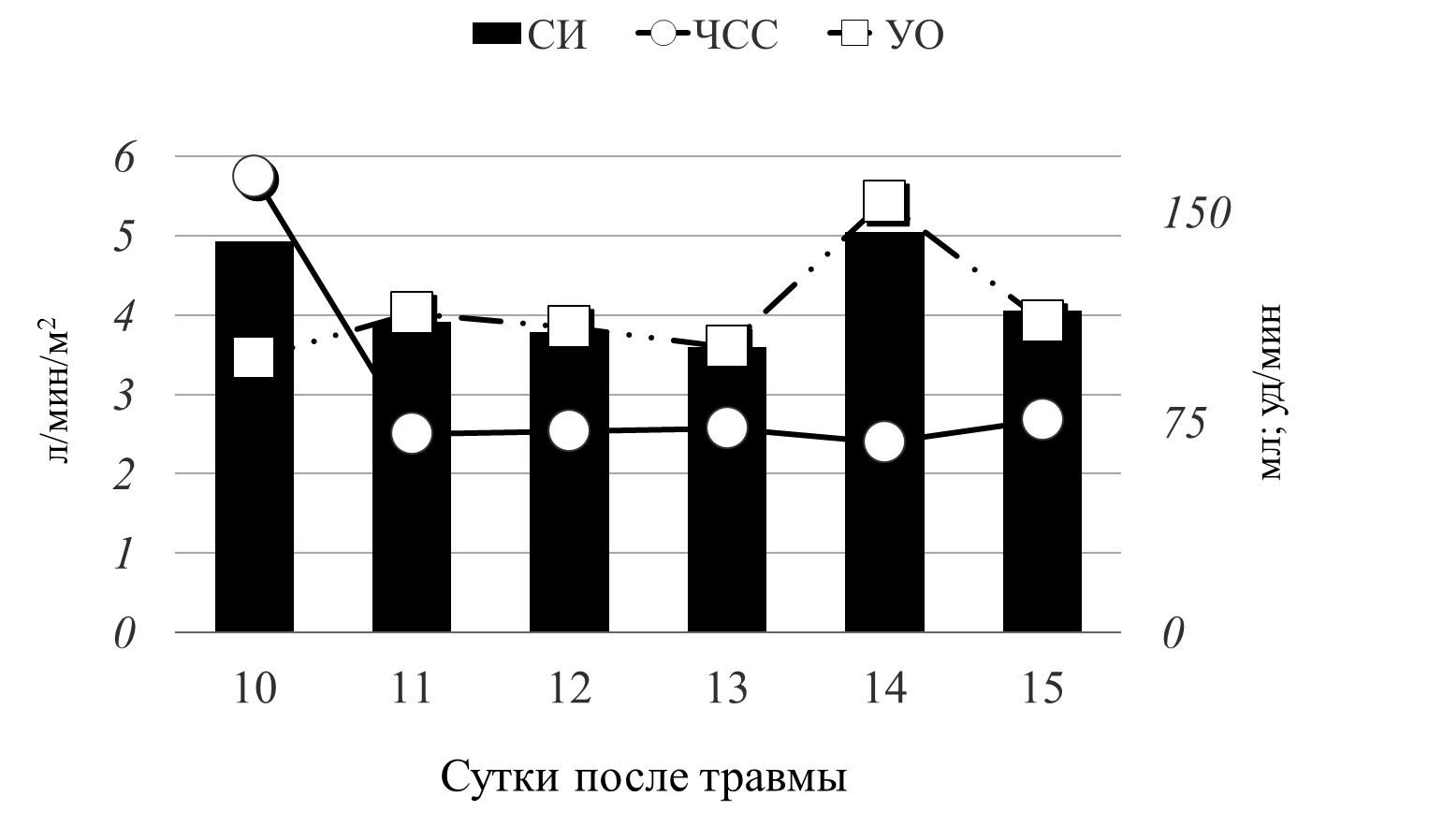
Рис 5 динамика СИ
График демонстрирует динамику сердечного индекса (рис.5). В течение первых суток септического шока нормальный уровень СИ поддерживался за счет выраженной тахикардии (ЧСС до 167 уд/мин) при низком ударном объеме - 87,6 мл. На фоне проводимой терапии мы добились нормализации сердечного ритма 80-83 уд/мин, при этом СИ поддерживался уже за счет адекватного УО – 160 мл.
Одним из методов поддержания необходимого среднего АД было применение симпатомиметиков (рис. 6).
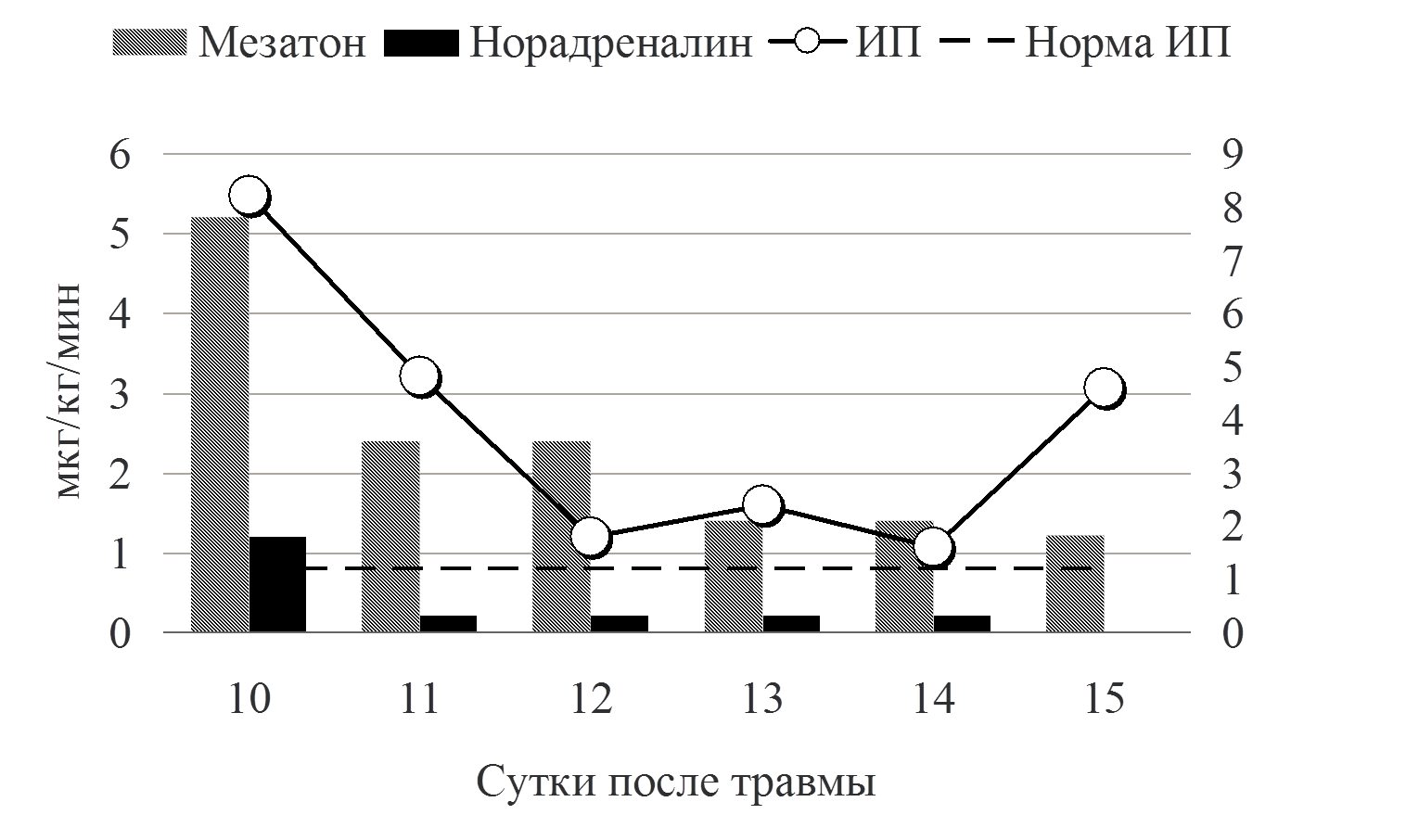
Рис. 6 Применение симпатомиметиков
В приводимом клиническом наблюдении требовалось сочетание двух препаратов мезатон (фенилэфрин) и норадреналин в высоких дозировках. Безопасность применения вазопрессоров контролировалась двумя показателями гемодинамики ОПСС и индексом перфузии (ИП). Из графика видно, что применение высоких доз симпатомиметоков не приводило к нарушению периферической циркуляции крови. Так, на начальном этапе при применении мезатона и норадреналина в дозировке 5,7 мкг/кг/мин и 1,4 мкг/кг/мин, соответственно, выявлялись относительно низкие цифры ОПСС (830 DSм2/см5) и высокий показатель ИП - 8. В дальнейшем в процессе терапии комбинацией симпатомиметиков ИОПСС не превышал физиологической границы (2000 DSм2/см5), а индекс перфузии не был ниже 1,2. Другим важным компонентом поддержания адекватных показателей системной гемодинамики является инфузионная терапия. При выборе тактики увеличения либо снижения темпа инфузионной терапии мы ориентировались на статические (ЦВД, ИВГОК) и динамические (ВУО) показатели волемии (рис.7).
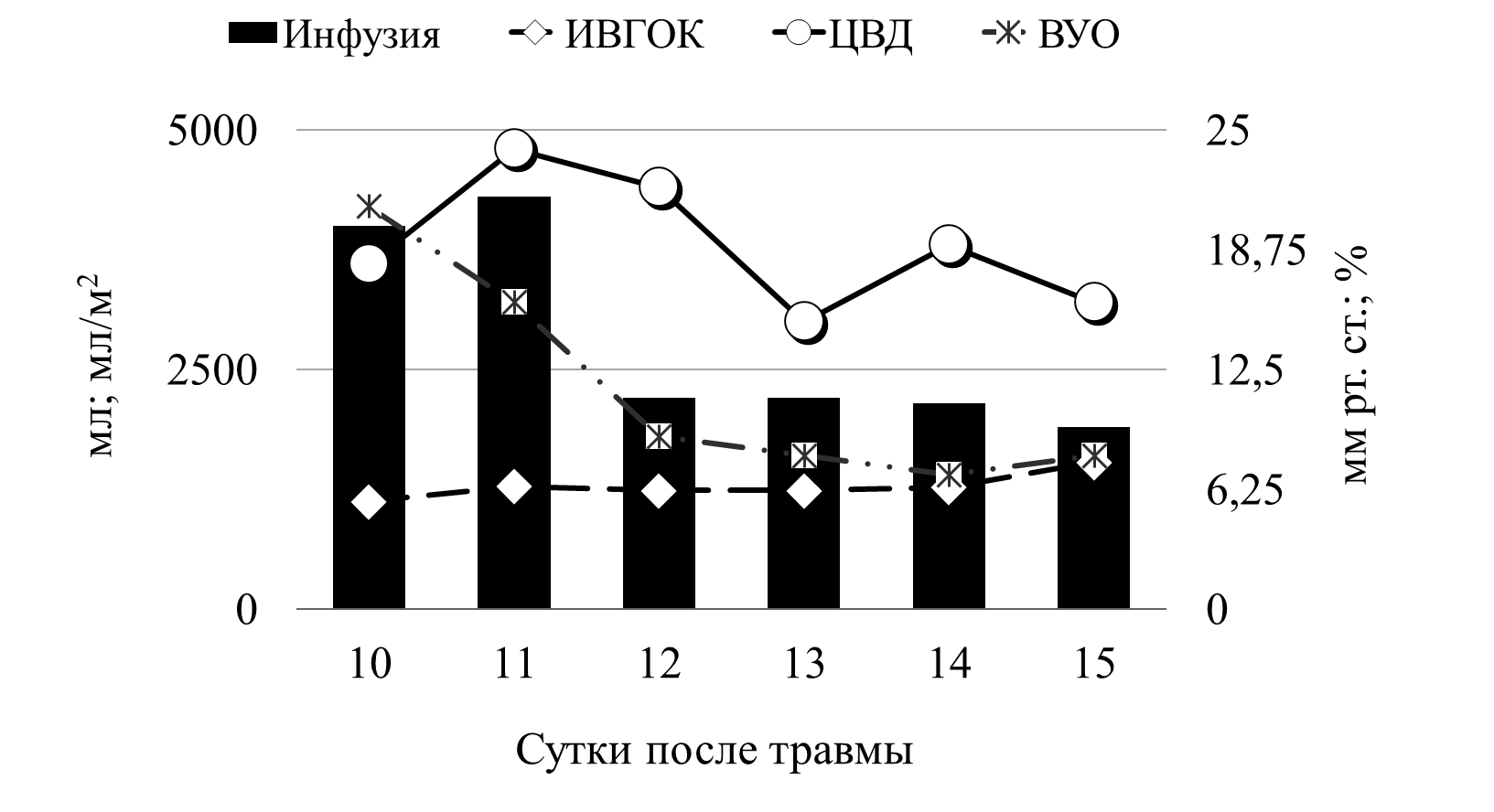
Рис. 7 Инфузионная терапия
На представленном графике видно, что с первых дней сепсиса статические показатели волемии были выше принятых нормальных значений, однако мы повышали темп и объем инфузионной терапии, ориентируясь на динамический показатель волемии. Как указывалось выше, у пациентов с тЧМТ критическим моментом является предупреждение артериальной гипотензии. В обсуждаемом клиническом наблюдении для поддержания адекватного АД при развитии септического шока было необходимо использовать два симпатомиметка: норадреналин и мезатон. В настоящее время, так и не сложилось однозначного отношения к выбору симпатомиметических препаратов для коррекции артериальной гипотензии у пациентов с тяжелым сепсисом. Несмотря на то, что в «Руководстве по ведению пациентов с тяжелым сепсисом и септическим шоком» препаратами выбора считаются допамин и норадреналин, ряд авторов получили достаточно противоречивые результаты при использовании этих препаратов [11]. Так Azarov et al выявил связь между применением допамина и увеличением смертности при септическом шоке [12]. Backer et al., не нашел никаких существенных различий в летальности между пациентами, получавшими допамин и норадреналин, однако отметил большее число побочных эффектов при применении допамина [13]. Gaurav Jain and D. K. Singh, показали, что мезатон сопоставим с норадреналином в коррекции гемодинамических и метаболических нарушений при сепсисе [14]. Shenoy et al., проведя мета-анализ применения допамина и норадреналина у пациентов с тяжелым сепсисом, пришли к выводу, что при наличии тех или иных гемодинамических преимуществ каждого, нельзя говорить о превосходстве одного симпатомиметика над другим [15]. В приведенном клиническом наблюдении выбор препарата основывался на данных расширенного мониторинга и выявлении причины снижения АД. Было выявлено, что у пациента на фоне сохраненной сократительной способности миокарда (адекватная фракция изгнания и высокие цифры ВОУ) отмечался вазопаралич (низкое ОПСС и высокий показатель ИП). Для нормализации этих показателей, было необходимо применять комбинацию мезатона с норадреналином. Высокие дозы этих препаратов применяли, используя ОПСС и ИП как критерии безопасности проводимой вазопрессорной терапии. Это позволило избежать выраженной вазоконстрикции и нарушения периферического кровотока. Необходимо отдельно остановиться на ИП. Этот показатель, достаточно широко обсуждаемый в англоязычной литературе, незаслуженно, на наш взгляд, обделен вниманием отечественными авторами. ИП рассчитывается исходя из анализа плетизмографической волны. Она состоит из двух компонентов обозначаемых как DC и AC. DC - это непульсирующий компонент плетизмографического сигнала (от венозной и нециркулирующей артериальной крови), а AC – пульсирующий компонент пульсовой вольны (от пульсирующей артериальной крови). ИП рассчитывается как AC/DC × 100%, и автоматически выводится на большинство прикроватных мониторов [16]. Высокие показатели этого индекса говорят о вазодилятации. А низкие о выраженной вазоконстрикции, в том числе и при избыточном применении симпатомиметиков, либо в сочетании с выраженной гиповолемией [16]. ИП позволяет не только диагностировать нарушение микроциркуляции конечностей, но и прогнозировать нарушение спланхнического кровотока [17,18,19 ]. Таким образом, данные расширенного гемодинамического мониторинга, мониторинга периферического кровообращения позволили использовать у пациента К., с тЧМТ, осложнённой септическим шоком, высокие дозы вазопрессоров для поддержания адекватного ЦПД без нарушения микроциркуляции и развития полиорганной недостаточности.
Заключение
Дополненный исследованием интерлейкинов стандартный скрининг маркеров воспаления в сочетании с расширенным гемодинамическим мониторингом способствовали своевременному проведению патогенетической терапии с учетом индивидуальных характеристик гемодинамического профиля у пациента с тяжелой черепно-мозговой травмой, осложненной септическим шоком. Проведенная терапия обеспечила адекватную церебральную перфузию, без ущерба для микроциркуляции во внутренних органах, что позволило добиться регресса неврологической симптоматики и избежать развития полиорганной недостаточности.
Список литературы:
- Потапов А.А., Гайтур Э.И., Мухаметжанов Х., и др.: Тяжелая черепно-мозговая травма, сопровождаю-щаяся гипоксией и гипотензией у взрослых и детей.// В кн.: Неотложная хирургия детского возраста. Москва. Мед. 1996.
- Bouma G.J. Relationship between cardiac output and cerebral blood flow in patients with intact and with impaired autoregulation/ Bouma G.J., Muizelaar J.P. //J. Neurosurg.,1990. -p.368-374.
- Yuthana Udomphorn, MD, William M. Armstead, Ph.D, and Monica S. Vavilala, MD //Cerebral Blood Flow and Autoregulation after Pediatric Traumatic //Pediatr Neurol. 2008 April ; 38(4): 225–234
- Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA et al.// Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis.College of Chest Physicians/Society of Critical Care Medicine.Chest 1992;101:1644-55.
- Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock:2008. Intensive Care Med 2008;34:17-60.
- Luzzani A, Polati E, Dorizzi R, Rungatscher A, Pavan R, Merlini A. Comparison of procalcitonin and C-reactive protein as markers of sepsis. Crit Care Med 2003;31:1737-41.
- Meisner M, Adina H, Schmidt J.// Correlation of procalcitonin and C-reactive protein to inflammation, complications, and outcome during the intensive care unit course of multiple-trauma patients//. Crit Care 2006; 10:R1.
- Assicot M, Gendrel D, Carsin H, Raymond J, Guilbaud J, Bohuon C. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet. Feb 27; 1993 341(8844):515–518. [PubMed: 8094770]
- Tang BM, Eslick GD, Craig JC, McLean AS. Accuracy of procalcitonin for sepsis diagnosis in critically ill patients: systematic review and meta-analysis. Lancet Infect Dis. Mar; 2007 7(3):210–217. [PubMed: 17317602]
- Guidelines for the management of severe traumatic brain injury. J Neurotrauma 2007;24(Suppl 1).
- Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock// Crit Care Med 2004 Vol. 32, No. 3
- Nick Azarov, Eric B. Milbrandt, Michael R. Pinsky// Could dopamine be a silent killer? //Critical Care 2006, 11: 302
- De Backer D1, Biston P, Devriendt J, Madl C, Chochrad D, Aldecoa C, Brasseur A, Defrance P, Gottignies P, Vincent JL// Comparison of dopamine and norepinephrine in the treatment of shock// N Engl J Med 2010; 362:779-789
- Gaurav Jain, D. K. Singh// Comparison of phenylephrine and norepinephrine in the management of dopamine-resistant septic shock// Indian J Crit Care Med. 2010 Jan–Mar; 14(1): 29–34.
- S Shenoy, A Ganesh, A Rishi, V Doshi, S Lankala, J Molnar, and S Kogilwaimath// Dopamine versus norepinephrine in septic shock: a meta-analysis// Crit Care. 2011; 15(Suppl 1): P89.
- Shelley KH, Murray WB, Chang D//Arterial-pulse oximetry loops: a new method of monitoring vascular tone//J Clin Monit 1997, 13:223-8.
- Hummler HD, Engelmann A, Pohlandt F, Högel J, Franz AR// Decreased accuracy of pulse oximetry measurements during low perfusion caused by sepsis: Is the perfusion index of any value?// Intensive Care Med 2006, 32:1428-31.
- Mowafi HA, Ismail SA, Shafi MA, Al-Ghandi AA//The efficacy of perfusion index as an indicator for intravascular injection of epinephrine-containing epidural test dose in propofolanesthetized adults. //Anesth Analg 2009, 108:549-53.
- Aoyagi T, Fuse M, Kobayashi N, Machida K, Miyasaka K// Multiwavelength pulse oximetry: theory for the future.//Anesth Analg 2007, 105(6 Suppl):S53-8.






