Внутричерепная гипертензия остается одной из ведущих причин высокой летальности и инвалидизации среди пострадавших с тяжелой черепно-мозговой травмой (ЧМТ) [1—4, 6]. Частота ее среди пострадавших с ЧМТ, находящихся в коме, колеблется от 40 до 60% [6—8]. Нейрохирургические методы занимают особое положение в арсенале методик коррекции внутричерепной гипертензии. К ним относятся: эвакуация интракраниальных гематом, наружное вентрикулярное дренирование, декомпрессивная краниоэктомия [1—3, 6]. Своевременная диагностика и быстрая эвакуация патологических интракраниальных масс является основным элементом при лечении пострадавших с ЧМТ, наряду с устранением факторов вторичного повреждения головного мозга. При травме головного мозга ключевыми способами диагностики нейрохирургических проблем являются методы нейровизуализации головного мозга: КТ, МРТ [3—5]. Показания для нейрохирургического вмешательства определяются на основании оценки волюмометрических критериев и их динамики: объема патологического субстрата, и степени компрессии базальных цистерн, величины смещения срединных структур мозга и т. д. [1, 4, 5]. Основным механизмом действия декомпрессии является создание дополнительного пространства для компенсации увеличенного внутричерепного объема [6—8, 11]. Считается, что эффективность декомпрессии зависит от размера декомпрессионного окна [9—11]. Дополнительным критерием в принятии решения о декомпрессивной краниоэктомии служит мониторинг ВЧД. При повышении внутричерепного давления (ВЧД) выше 20 мм рт.ст., которое не удается устранить методами интенсивной терапии (седация, обезболивание, гипервентиляция, гиперосмолярные растворы), принимается решение об усилении консервативной терапии и/или о декомпрессивной краниоэктомии. Параметры ВЧД, такие как средняя величина и длительность повышения выше 20 мм рт.ст., были использованы в двух последних рандомизированных исследованиях с применением декомпрессивной краниоэктомии [12, 13]. В этих исследованиях использовались разные дизайны, критерии включения, а также границы и длительность внутричерепной гипертензии для принятия решения о декомпрессии. По срокам выполнения декомпрессии в данных исследованиях условно разделяли на ранние вторичные, или нейропротективные, и отсроченные вторичные, когда нейрохирургическое вмешательство рассматривали как последнюю ступень коррекции внутричерепной гипертензии (ВЧГ) [14].
В нашем клиническом примере мы использовали патофизиологический подход к решению вопроса о декомпрессии на основании расширенного мониторинга ВЧД и церебрального перфузионного давления (ЦПД) и коэффициента ауторегуляции Prx [15]. Обсуждаемый пациент входил в группу пострадавших с ЧМТ, у которых выполнялась декомпрессия на фоне декомпенсации ауторегуляции мозговых сосудов и развития внутричерепной гипертензии [15]. Состояние декомпенсации и истощения резервов консервативной терапии мы оценивали на основании динамики коэффициента Prx выше 0,2. Оценка ауторегуляции мозговых сосудов проводилась с помощью корреляционного коэффициента Prx. Расчет Prx производился с помощью программы ICM Plus (Кембридж, Великобритания) и представлял коэффициент корреляции между ВЧД и САД. Коэффициент Prx рассчитывался автоматически по 40 последовательным усредненным значениям ВЧД и АД, данный расчет повторялся в пределах скользящего окна каждые 5 с. Значения Prx — от 1 до 0,2 расценивались как сохранная или частично сохранная ауторегуляция. Значения Prx от 0,2 до 1 расценивалось как полностью утраченная ауторегуляция.
Клинический пример
Первые сутки с момента травмы. Пострадавший мужчина 39 лет получил травму при падении с квадроцикла. Утрата сознания на месте травмы. С места травмы был доставлен в городской стационар. На момент госпитализации состояние оценивалось как сопор, 9 баллов по шкале комы Глазго (ШКГ), отмечались периоды психомоторного возбуждения. Зрачки узкие, по средней линии, фотореакция слабая с двух сторон. Левосторонний гемипарез. На К.Т.: очаги ушибов в лобных долях с двух сторон, левой височной доле, конвекситальное субарахноидальное кровоизлияние (САК). Умеренный отек за счет левого полушария, охватывающая цистерна прослеживается. Желудочковая система и субарахноидальные пространства сужены. В связи с нарастанием дыхательной недостаточности, необходимостью проведения седативной терапии была выполнена интубация трахеи, проводилась искусственная вентиляция легких (ИВЛ). АД 130/80 мм рт.ст., ЧСС 108 уд/мин. Больной находился на ИВЛ, получал седативную, противоотечную, антибактериальную терапию.
Вторые сутки. Пострадавший был переведен в НИИ нейрохирургии. Диагноз: тяжелая открытая ЧМТ. Ушиб головного мозга тяжелой степени с формированием множественных очагов ушиба (33 вида) в лобных долях с двух сторон, левой височной доле. Линейный перелом затылочной кости слева с переходом на основание. Травматическое САК. На К.Т. сохраняется прежняя картина (рис. 1).
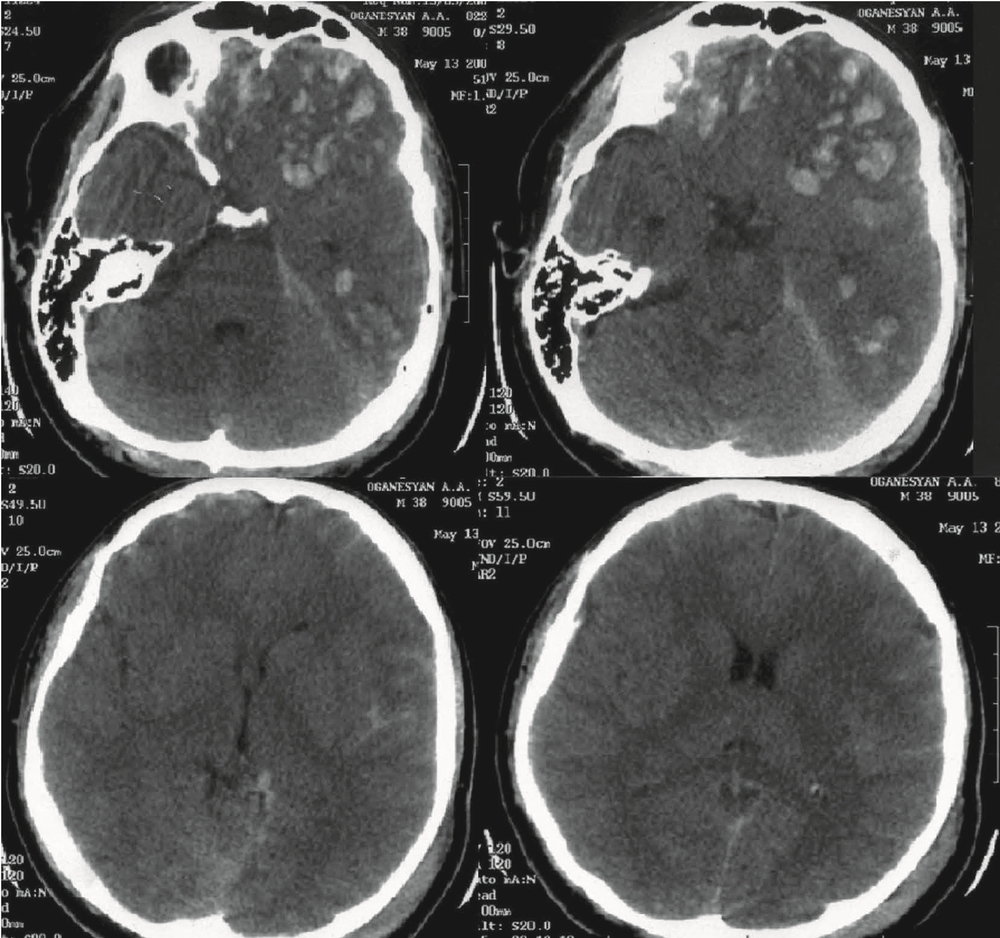
Неврологически: ШКГ 9 баллов, на настойчивое обращение получено сжимание в кистях рук. Фотореакция живая, корнеальный рефлекс получен, рефлекторный взор вверх получен на струйное раздражение. Нижнюю челюсть удерживает, живой кашлевой рефлекс. Сохраняется выраженное моторное беспокойство, стереотипность в движениях. АД в пределах 120—130/60—70 мм рт.ст. ЧСС 80—90 уд/мин. ИВЛ в режиме SIMV, RR 10, Vt 0,8 L, PS 14 cm H2O, PEEP 6 cm H2O, FiO2 40%. Учитывая данные КТ, острый период тяжелой ЧМТ, необходимость проведения седативной терапии, было принято решение о проведении мониторинга ВЧД. Паренхиматозный датчик показал: ВЧД 25—29 мм рт.ст., амплитуда ВЧД выше 7 мм рт.ст. Больному проводилась ИВЛ в режиме нормовентиляции, коррекция внутричерепной гипертензии и обеспечение ЦПД выше 60 мм рт.ст. Получал фентанил 100 мкг/ч и пропофол 150 мг/ч. При повышении ВЧД свыше 20 мм рт.ст. введение маннитола 1г/кг массы тела, вазопрессорная поддержка с целью контроля ЦПД.
Третьи сутки. При осмотре через 30 мин после отключения седации и наркотических анальгетиков, была отмечена отрицательная динамика — грубый орально-стволовой синдром в виде симптома Мажанди, узких зрачков, ограничение рефлекторного взора вверх, гиперсаливация. Глотательные движения и кашлевой рефлекс резко угнетены. Низкий мышечный тонус в конечностях. Неврологический осмотр был прекращен из-за эпизода повышения ВЧД до 30—35 мм рт.ст., которое устранено гипервентиляцией, возобновлением седации и аналгезии в прежних дозах, дополнительно проведена инфузия маннитола: 15%, 400 мл. От проведения теста с пробуждением в дальнейшем решено было отказаться. Осмолярность и уровень натрия в плазме были в норме. ИВЛ, SIMV, RR 14, Vt 0,78 L, PS 14 cm H2O, PEEP 6 cm H2O, FiO2 40%. ЕтСО2 30 мм рт.ст. В течение суток субфебрильная температура до 37,7—38 °C. Проводилась контролируемая нормотермия системой наружного охлаждения TropyCool до 36,5—37 °C. Гемодинамика поддерживалась вазопрессорами (мезатон 8—10 мг/ч). АД 135—165/70—90 мм рт.ст. По данным нейромониторинга (рис. 2), ВЧД от 18 до 35 мм рт.ст. ЦПД от 60 до 95 мм рт.ст., коэффициент ауторегуляции Prx — от 0,5 до 0,1.
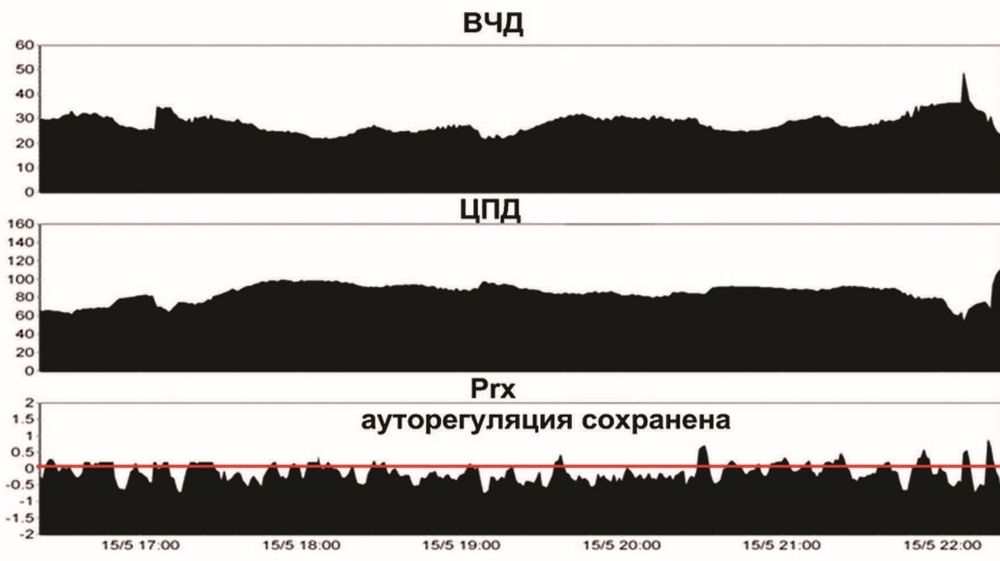
КТ повторно не выполнялась из-за нестабильной гемодинамики и ВЧГ, которую провоцировали минимальные манипуляции и изменение положения больного. Наложение трахеостомы было отложено до стабилизации состояния больного. Проводилась консервативная терапия под контролем нейромониторинга.
Четвертые сутки. Повторялись эпизоды ВЧГ. В течение их отмечено появление плато волн ВЧД до 40 мм рт.ст., кратковременное снижение ЦПД ниже 50 мм рт.ст. на фоне плато волн. В динамике отмечена устойчивая тенденция к увеличению коэффициента Prx выше 0,2, что свидетельствовало о срыве ауторегуляции мозгового кровотока (рис. 3).
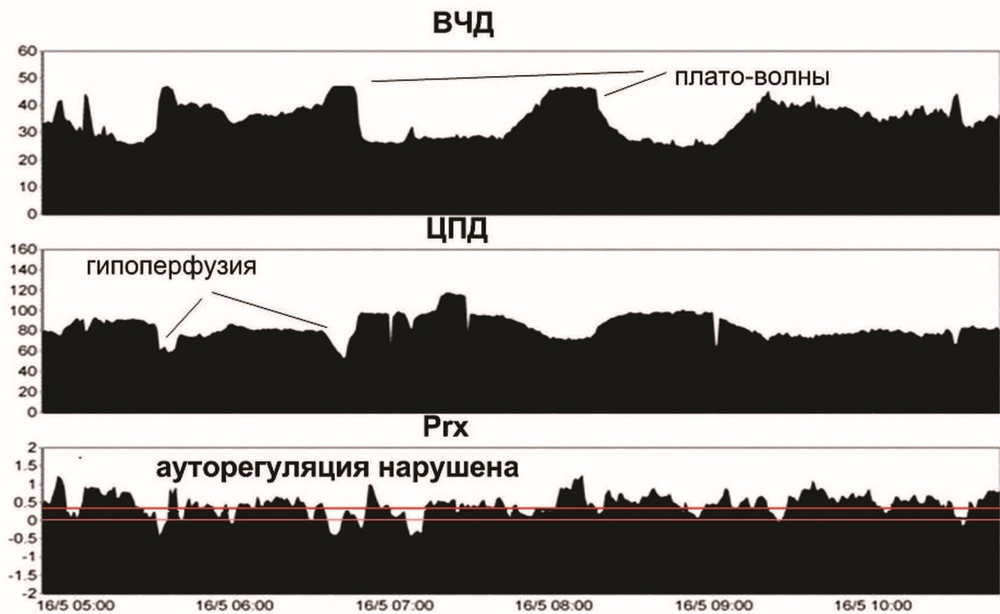
Произведено углубление седации: пропофол 250—300 мг/ч, фентанил в прежней дозе, глубокая гипервентиляция до ЕтСО2 28 мм рт.ст. под контролем югулярной оксиметрии SvjO2 не ниже 50%. Натрий — от 145 до 149 ммоль/л. Осмолярность — 310 мосмоль/л. В течение суток 15% раствор маннитола был использован четырехкратно, в общем объеме 1600 мл. После совместного обсуждения с нейрохирургами было решено выполнить декомпрессивную трепанацию. Операция: декомпрессивная краниоэктомия лобно-теменно-височной области с двух сторон. Удаление субдуральной гигромы слева объемом 30 мл. Пластика твердой мозговой оболочки надкостничным лоскутом слева.
5—6-е сутки. В послеоперационном периоде отмечалась стабилизация ВЧД 5–12 мм рт.ст., ЦПД на уровне 60—65 мм рт.ст., Prx>0,2 (рис. 4).
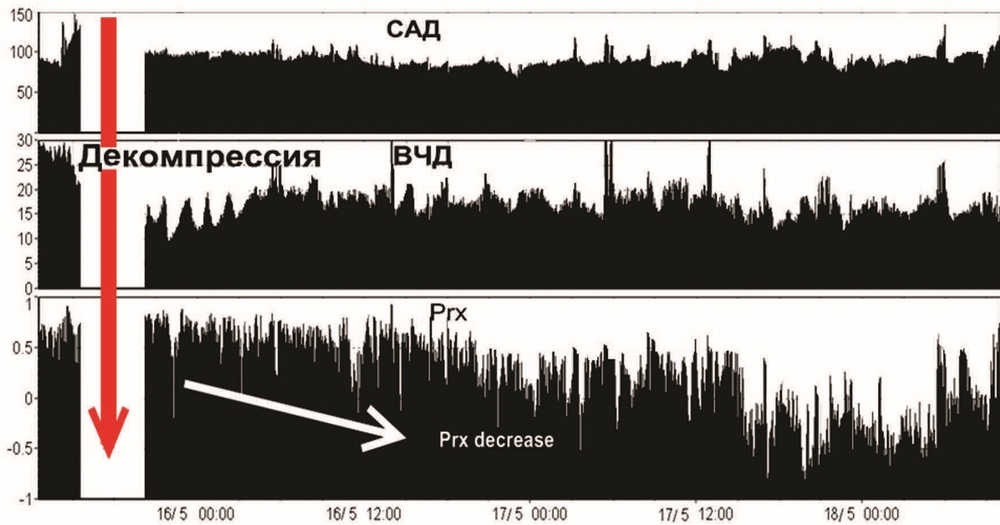
Доза пропофола снижена до 80 мг/ч, введение фентанила прекращено, доза мезатона уменьшена до 5 мг/ч. Контролируемая нормотермия прекращена, температура субфебрильная до 37,8 °C. При осмотре вне седации: ШКГ 6 баллов, приведение со сгибанием в правой руке, без отчетливой локализации, слабое сгибание в правой ноге. При пассивном открывании век глазные яблоки фиксированы в центральном положении, зрачки узкие, фотореакция ослаблена, слабый корнеальный рефлекс с двух сторон, редкие мигательные движения век. Нижняя челюсть отвисает, из ротовой полости обильное слюнотечение, язык несколько выступает за линию резцов, отечный. Нижнечелюстной рефлекс получен. АД 120—145/85—80 мм рт.ст., ЧСС 65–90 уд/мин, ритм синусовый. ИВЛ, SIMV RR 14, Vt 0,75 L, PS 12 cm H2O, PEEP 7 cm H2O, FiO2 40%. Дыхание в легких симметричное с двух сторон, жесткое, незначительное ослабление в заднебазальных отделах с двух сторон. Отмечается нарастание воспалительных маркеров в крови: лейкоцитоз со сдвигом формулы влево, ЦРП 178 мг/л. Рентгенологически — двусторонняя пневмония. Проводилась антибактериальная терапия с учетом чувствительности флоры. Выполнена транскутанная дилатационная трахеостомия.
7—11-е сутки. Стабилизация гемодинамики, прекращение вазопрессорной поддержки и седативной терапии. Сохранялась субфебрильная температура. АД 120—130/60—70 мм рт.ст. ЧСС 80—90 уд/мин. ВЧД в пределах 5—7 мм рт.ст., ЦПД 60—65 мм рт.ст. Значения Prx варьировали от 0 до –0,1, что свидетельствовало о восстановлении ауторегуляции. Нейромониторинг прекращен на 11-е сутки.
12—20-е сутки. Состоялся регресс инфекционно-воспалительных проявлений, нормализовалась температура, разрешилась двусторонняя пневмония. В неврологическом статусе положительная динамика: ШКГ 10 баллов, легкий правосторонний гемипарез. Выполняет отдельные инструкции: пожимает руки по просьбе, активно жестикулирует. Стабильная гемодинамика, проводилась дыхательная реабилитация, переведен в СРАР 5 cm H2O, FiO2 =25%, PS 10 cm H2O.
30-е сутки. Пациент на фоне восстановления сознания был отключен от ИВЛ. Гемодинамика стабильная. Через 22 мес в связи с появлением раневой ликвореи больному успешно выполнена плаcтика ТМО в левой лобно-теменно-височной области. Позже в связи с развитием гидроцефалии было выполнено вентрикуло-перитонеальное шунтирование справа. Через 5 мес пациент был выписан из стационара. В неврологическом статусе сохранялся легкий правосторонний гемипарез, сенсорно-моторная афазия. Восстановилось глотание, был деканюлирован. В дальнейшем пациент проходил курсы реабилитационно-восстановительного лечения до 2 раз в год. Через 12 мес состояние по шкале исходов Глазго оценивалось как умеренная инвалидизация.
Обсуждение
Представленным клиническим примером показано, что наряду с традиционным мониторингом параметров ВЧД и ЦПД мониторинг ауторегуляции мозговых сосудов позволяет своевременно принимать решение о выполнении декомпрессивной краниоэктомии. В представленном клиническом наблюдении стойкая регистрация срыва ауторегуляции на 4-е сутки свидетельствовала о дальнейшей невозможности использования медикаментозных манипуляций со средним артериальным давлением и соответственно лишало возможности безопасного обеспечения ЦПД выше 60 мм рт.ст. В соответствии с вышесказанным любые попытки повышения САД приводили бы к пассивному повышению ВЧД и дальнейшему снижению ЦПД. Можно предположить, что при отсутствии мониторинга ауторегуляции интенсивная терапия протекала бы по варианту дальнейшего наращивания агрессивности, так как были сохранны резервы по использованию гиперосмолярных растворов, кроме того, удавалось снижать ВЧД на углубление седации и проводить безопасное углубление гипервентиляции под контролем югулярной оксиметрии. Однако в создавшейся клинической ситуации осмотические диуретики не могли рассматриваться как средство продленной коррекции ВЧГ, так как прослеживалась тенденция к гипернатриемии, а введение маннитола достигло максимальных суточных доз. При наращивании агрессивности лечения ВЧГ в арсенале реаниматолога оставались методы гипотермии и барбитуровой комы. Барбитураты способны эффективно устранять внутричерепную гипертензию, но количество побочных осложнений, вызванных их использованием, нивелирует их положительный эффект на ВЧД [16, 17]. Одним из грозных осложнений является артериальная гипотензия, которая является мощным повреждающим фактором для травмированного мозга и значительно ухудшает исход при ЧМТ [16, 17]. Можно предполагать, что использование барбитуратов у данного пациента потребовало бы более высоких доз вазопрессоров и агрессивной инфузионной терапии, что само по себе могло привести к различным осложнениям: отеку легких, почечной недостаточности, сердечно-сосудистой недостаточности и т. д. [18, 19]. Барбитураты на сегодняшний день рассматриваются как последняя ступень агрессивной терапии ВЧГ, и их использование не улучшает исходы при ЧМТ [1, 4, 6, 7, 16, 17].
Метод гипотермии зарекомендовал себя эффективным методом коррекции внутричерепной гипертензии. Однако международные многоцентровые исследования не показали улучшения исходов при использовании гипотермии в сравнении с традиционными методами интенсивной терапии [18]. При этом было отмечено, что количество побочных осложнений, связанных с использованием гипотермии, не уступает их количеству при использовании барбитуратов [19, 20]. Декомпрессивная краниоэктомия также не является панацеей, но в нашем клиническом случае продемонстрировала свою эффективность для коррекции ВЧГ и стабилизации ЦПД. Кроме того, после декомпрессии появилась возможность для снижения агрессивности методов интенсивной терапии в виде уменьшения доз седативных препаратов и катехоламинов. Мы смогли отменить наркотические анальгетики, отказаться от гипервентиляции, прекратить введение гиперосмолярных растворов и достигнуть нормализации уровня натрия и восстановления ауторегуляции.
Таким образом, продемонстрирована возможность нового подхода к принятию решения о декомпрессивной краниоэктомии у пострадавших с травматическим отеком головного мозга и внутричерепной гипертензией. Суть нового подхода заключается в непрерывной оценке ауторегуляции мозговых сосудов с помощью коэффициента Prx наряду с такими важными параметрами нейромониторинга, как ВЧД и ЦПД. Мониторинг коэффициента Prx позволяет своевременно распознавать срыв ауторегуляции мозговых сосудов и дает возможность принять решение о выполнении декомпрессивной краниоэктомии до момента наращивания агрессивных методов интенсивной терапии (гипотермии и барбитуровой комы).
Конфликт интересов отсутствует.
Комментарий
В клиническом примере, описанном группой авторов, представлены новые возможности нейромониторинга у пострадавших с тяжелой ЧМТ. Благодаря программному обеспечению, дополнительно с АД, ВЧД, ЦПД, проводилось непрерывное измерение статуса ауторегуляции мозгового кровотока с помощью коэффициента Prx (pressure reactivity index) [1].
Публикации последних 5–7 лет подтверждают, что данный параметр нейромониторинга занимает одно из ведущих мест и активно используется при определении стратегии интенсивной терапии у пострадавших с острым церебральным повреждением. Интерес к проблеме мониторинга ауторегуляции мозгового кровотока значительно возрос, и этому есть несколько причин. Во-первых, значимую роль играют доступность и низкая цена метода, основанного на компьютерном анализе медленноволновых колебаний АД и ВЧД. Именно этот факт обеспечил широкое распространение метода оценки ауторегуляции в нейроинтенсивной терапии. Во-вторых, актуальность мониторинга ауторегуляции была подчеркнута в Международных рекомендациях по ведению пострадавших с ЧМТ [2]. В-третьих, созрела необходимость проводить индивидуализацию интенсивной терапии на основании многопараметрического нейромониторинга, с учетом тяжести и давности церебрального повреждения, возраста пострадавшего, сопутствующей соматической патологии, факторов вторичного повреждения головного мозга и т.д. [3,4].
Своевременность оказания нейрохирургического пособия, бесспорно, остается ведущим фактором, определяющим исход у пострадавших с ЧМТ. Декомпрессивная краниоэктомия — один из методов коррекции ВЧГ среди данной категории пострадавших, особенно при развитии внутричерепной гипертензии. К сожалению, сроки выполнения декомпрессивной краниоэктомии не определены. Использование различных стратегий: ранней «нейропротективной» или отсроченной декомпрессии — не показали убедительных преимуществ и не дали ожидаемого улучшения исходов при ЧМТ.
В предложенной работе показан совершенно новый подход, который можно назвать патофизиологическим, основанный на оценке ауторегуляции. По мнению авторов, срыв ауторегуляции мозгового кровотока является сигналом для выполнения декомпрессивной краниоэктомии. Это выглядит вполне обоснованным, так как при отсутствии ауторегуляции поддержание ЦПД на фоне внутричерепной гипертензии становится весьма проблематичным. На примере клинического случая авторам удалось наглядно показать клиническую ценность применения коэффициента ауторегуляции Prx у пациентов с тяжелой черепно-мозговой травмой. Результаты изложены четко и содержательно обсуждены в контексте современных публикаций на эту тему.
Представляется целесообразным дальнейшее исследование коэффициента ауторегуляции Prx, его внедрение в комплекс мер нейромониторинга у наиболее тяжелых категорий реанимационных больных и использование в качестве ориентира для целенаправленной терапии.
М.Ю. Киров (Архангельск)
Список литературы:
- Доказательная нейротравматология. Под ред. Потапова А.А., Лихтермана Л.Б. М.: Антидор. 2003;517.
- Клиническое руководство по черепно-мозговой травме. Под ред. Коновалова А.Н., Лихтермана Л.Б., Потапова А.А. М.: Антидор. 1998.
- Потапов А.А., Крылов В.В., Лихтерман Л.Б., Царенко С.В., Гаврилов А.Г., Петриков С.С. Современные рекомендации по диагностике и лечению тяжелой черепно-мозговой травмы. Вопросы нейрохирургии. 2006;1:3-8.
- Потапов А.А., Захарова Н.Е., Пронин И.Н., Корниенко В.Н., Гаврилов А.Г., Кравчук А.Д., Ошоров А.В., Сычев А.А., Зайцев О.С., Фадеева Л.М., Такуш С.В. Прогностическое значение мониторинга внутричерепного и церебрального перфузионного давления, показателей регионарного кровотока при диффузных и очаговых повреждениях мозга. Вопросы нейрохирургии. 2011;3:3-18.
- Zakharova N, Kornienko V, Potapov A, Pronin I. Neuroimaging of Traumatic Brain Injury. Springer International Publishing. Switzerland 2014. doi: 10.1007/978-3-319-04355-5.
- Maas AI, Dearden M, Teasdale GM, Braakman R, Cohadon F, Iannotti F, Karimi A, Lapierre F, Murray G, Ohman J, Persson L, Servadei F, Stocchetti N, Unterberg A. EBIC-guidelines for management of severe head injury in adults. European Brain Injury Consortium. Acta Neurochir (Wien). 1997;139(4):286-2–94. PubMed PMID:9202767.
- Stocchetti N, Zanaboni C, Colombo A, Citerio G, Beretta L, Ghisoni L, Zanier ER, Canavesi K. Refractory intracranial hypertension and ««second-tier»» therapies in traumatic brain injury. Intensive Care Med. 2008 Mar;34(3):461-467. Epub 2007 Dec 8. PubMed PMID: 18066523. doi:10.1007/s00134-007-0948-9.
- Miller JD, Becker DP, Ward JD, Sullivan HG, Adams WE, Rosner MJ. Significance of intracranial hypertension in severe head injury. J Neurosurg. 1977 Oct;47(4):503-516. doi:10.3171/jns.1977.47.4.0503.
- Bullock MR, Chesnut R, Ghajar J, Gordon D, Hartl R, Newell DW, Servadei F, Walters BC, Wilberger JE. Surgical Management of Traumatic Brain Injury Author Group. Surgical management of acute epidural hematomas. Neurosurgery. 2006Mar;58(3)Suppl:1-60; discussion Si-iv. Review. doi:10.1097/00006123-200603001-00006.
- Menon DK, Matta BF. Intensive care after acute head injury. In: Matta B, Menon D, Turner J, eds. Neuroanesthesia and Neurointensive Care. London: Greenwich Medical Media. 2000;301-317. doi:10.1016/b978-141604653-0.10034-2.
- Munch E, Horn P, Schurer L, Piepgas A, Torsten P, Schmidek P. Management of severe traumatic brain injury by decompressive сraniectomy. Neurosurgery. 2000;47:315-323. doi:10.1097/00006123-200008000-00009.
- Cooper DJ, Rosenfeld JV, Murray L, Arabi YM, Davies AR, D’Urso P, Kossmann T, Ponsford J, Seppelt I, Reilly P, Wolfe R. DECRA Trial Investigators, Australian and New Zealand Intensive Care Society Clinical Trials Group (2011) Decompressive craniectomy in diffuse traumatic brain injury. N Engl J Med. 2011;364:1493-1502. doi:10.1056/nejmoa1102077.
- Hutchinson PJ, Corteen E, Czosnyka M, Mendelow AD, Menon DK, Mitchell P, Murray G, Pickard JD, Rickels E, Sahuquillo J, Servadei F, Teasdale GM, Timofeev I, Unterberg A, Kirkpatrick PJ. Decompressive craniectomy in traumatic brain injury: the randomized multicenter RESCUEicp study (www.RESCUEicp.com). Acta Neurochir Suppl. 2006;96:17-20. doi:10.1007/3-211-30714-1_4.
- Kolias AG, Li LM, Guilfoyle MR, Timofeev I, Corteen EA, Pickard JD, Kirkpatrick PJ, Menon DK, Hutchinson PJ. Decompressive craniectomy for acute subdural hematomas: time for a randomized trial. Acta Neurochir (Wien). 2013 Jan;155(1):187-188. doi:10.1007/s00701-012-1531-x.
- Ошоров А.В., Савин И.А., Горячев А.С., Попугаев К.А., Потапов А.А., Гаврилов А.Г. Первый опыт применения мониторинга ауторегуляции мозговых сосудов в остром периоде тяжелой черепно-мозговой травмы. Анестезиология и реаниматология. 2008;2:61-64. doi:10.14412/1995-4484-2008-8.
- Cormio M, Gopinath SP, Valadka A, Robertson CS. Cerebral hemodynamic effects of pentobarbital coma in head-injured patients. J Neurotrauma. 1999 Oct;16(10):927-936. doi:10.1089/neu.1999.16.927.
- Roberts I, Sydenham E. Barbiturates for acute traumatic brain injury. Cochrane Database Syst Rev. 2012 Dec 12;12:CD000033. doi: 10.1002/14651858.cd000033.pub2.
- Robertson CS, Valadka AB, Hannay HJ, Contant CF, Gopinath SP, Cormio M, Uzura M, Grossman RG. Prevention of secondary ischemic insults after severe head injury. Crit Care Med. 1999 Oct;27(10):2086-2095. doi: 10.1097/00003246-199910000-00002.
- Sydenham E, Roberts I, Alderson P. Hypothermia for traumatic head injury. Cochrane Database Syst Rev. 2009 Apr 15;(2):CD001048. doi: 10.1002/14651858.cd001048.pub4. review. pubmed pmid: 19370561.
- Polderman KH. Mechanisms of action, physiological effects, and complications of hypothermia. Crit Care Med. 2009 Jul;37(7 Suppl):186-202. doi:10.1097/ccm.0b013e3181aa5241. review.






