Наружное вентрикулярное дренирование (НВД) широко используется у пациентов с различной интракраниальной патологией для выведения ликвора, обеспечения непрерывного мониторинга внутричерепного давления, а также прямого введения в желудочковую систему лекарственных препаратов [1—3]. По данным литературы [4], метод катетеризации желудочков мозга был впервые применен еще в конце XIX века, однако широко использоваться стал с 60-х годов XX века, когда методика была усовершенствована Лундбергом и применена прикроватно. Несмотря на жизнеспасающую функцию, НВД связано с рядом осложнений, таких как кровоизлияние по ходу установки дренажа, неправильная позиция дренажного катетера и инфекция ликворных путей [5]. Тот факт, что использование этой манипуляции значительно повышает риск развития инфекции центральной нервной системы (ЦНС), привел к выделению дренаж-ассоциированных менингитов в отдельную группу заболеваний [1, 6—13].
Большинство исследователей [14] относят к дренаж-ассоциированным менингитам нозокомиальные менингиты, которые возникают у больных с применением НВД. На данный момент для диагностики и учета нозокомиальных менингитов в зарубежной литературе широко используются клинико-лабораторные критерии CDC (Centers for Disease Control and Prevention — центров по контролю и профилактике заболеваний). Наиболее часто диагностика основывается на сочетании выделения патогена из ликвора с системными проявлениями инфекции и/или биохимическими, а также клеточными изменениями состава ликвора [9—13, 15—18]. Существуют работы [6, 18—20], в которых диагностика менингитов основана только на выделении патогена из ликвора, в то время как воспалительным изменениям в ликворе и крови отводится второстепенная роль. Отсутствие единого общепринятого определения инфекции, связанной с использованием НВД, затрудняет мониторинг уровня заболеваемости дренаж-ассоциированными менингитами [10, 11]. На основании стандартизированного определения, предложенного центрами по контролю и профилактике заболеваний (CDC), предлагается вычислять частоту дренаж-ассоциированных менингитов в зависимости от продолжительности дренирования [14]. Однако число работ, в которых оценивается показатель заболеваемости и частоты на 1000 дней дренирования, ограничено [10, 18].
Особенностью диагностики дренаж-ассоциированных менингитов у пациентов отделения реанимации и интенсивной терапии (ОРИТ) является акцент на лабораторные маркеры инфекции в ликворе при второстепенной роли клинических проявлений заболевания. Причина низкой информативности клинических признаков легко объяснима: больные отделений интенсивной терапии могут иметь разнообразную неврологическую симптоматику, вплоть до развития коматозного состояния [8].
Риск развития менингитов на фоне дренирования зависит от многих факторов: длительности нахождения дренажной трубки, техники ее установки, ухода за дренажом и манипуляций с ним (частота забора ликвора, промывания, эпизоды разъединения), развития ликвореи через установочный ход, длительности пребывания пациента в ОРИТ, наличия у него других очагов инфекции [1, 6—8, 10, 12, 13, 21]. Существует мнение, что наличие крови в желудочковой системе (в частности, при разрыве аневризм или артериовенозной мальформации — АВМ — сосудов головного мозга) способствует развитию инфекции [8, 10—12, 21, 22]. Многие актуальные вопросы, касающиеся установки и использования наружных вентрикулярных дренажей, были специально рассмотрены профессиональным сообществом и опубликованы в 2016 г. в качестве рекомендаций [5]. Экспертной комиссией было установлено, что имеющиеся по ряду вопросов данные противоречивы или недостаточны, что обосновывает необходимость дальнейших исследований [5].
Цель исследования
— на основании анализа собственных наблюдений определить показатели заболеваемости и факторы риска развития дренаж-ассоциированных менингитов у пациентов отделения нейрореанимации.
Материал и методы
Работа представляет собой проспективное исследование, в которое были включены все пациенты, находившиеся в ОРИТ ННПЦН им. акад. Н.Н. Бурденко более 48 ч, в период с октября 2010 г. по октябрь 2015 г. Данные обо всех пациентах ежедневно вносили в специальную форму электронной истории болезни. Для диагностики дренаж-ассоциированных менингитов использовали стандартные определения случаев нозокомиального менингита (Definitions of Nosocomial Infections), разработанные Центрами по контролю заболеваемости США (Centers for Disease Control) [14]. Необходимыми критериями считались: 1) изолированное выделение микроорганизма (-ов) из ликвора с помощью культуральных или некультуральных микробиологических методов; 2) комбинация клинических (лихорадка или головная боль, менингеальные знаки, другие неврологические симптомы) и лабораторных критериев менингита (плеоцитоз, повышение белка и снижение глюкозы в ликворе, визуализация микробов в ликворе при окраске по Граму).
В качестве дополнительного показателя, позволяющего характеризовать влияние ведущего фактора риска, рассчитывали частоту дренаж-ассоциированных менингитов на 1000 дней дренирования. Для расчета использовалась формула:
Частота дренаж-ассоциированных менингитов
= Общее число менингитов у больных с НВД / Общее количество дней дренирования ·1000
Для оценки статистической значимости различий в частоте встречаемости явления в двух группах был использован критерий χ2. Для сравнения непрерывных случайных величин в двух группах использован тест Вилкоксона—Манна—Уитни. Различия считали статистически значимыми на уровне 0,05.
Результаты и обсуждение
За 5-летний период было зарегистрировано 2140 случаев поступления в ОРИТ пациентов, соответствующих вышеуказанным критериям. У 539 из них в условиях отделения реанимации проводилось НВД. Суммарное число дней дренирования составило 5418. У 38 больных менингит развился до установки наружных дренажей и они были исключены из анализируемой группы. В результате анализ проведен на материале 501 пациента. У 1633 пациентов отделения реанимации наружное дренирование до развития менингита не проводилось. В этой популяции нозокомиальный менингит развился у 81 (5%) больного.
Дренаж-ассоциированный менингит был диагностирован у 99 больных, что составило 19,8 (95% ДИ 16,3—23,3) на 100 пациентов с дренажами и 18,3 (95% ДИ 14,3—22,2) на 1000 дней дренирования. Уровень заболеваемости дренаж-ассоциированными менингитами, по данным литературы, варьирует в широких пределах 5,6—23,2% [1, 6—9, 23, 24]. Приводимый в литературе показатель на 1000 дней дренирования составляет в среднем 11,4 и характеризуется значительной вариабельностью, связанной с рядом причин: критериями, используемыми для диагностики дренаж-ассоциированных инфекций, длительностью дренирования, применением антибиотиков [18]. Таким образом, полученные в нашем исследовании показатели заболеваемости в популяции реанимационных больных соответствуют данным литературы.
Мы провели сравнительный анализ двух групп пациентов: больных, у которых на фоне НВД развился дренаж-ассоциированный менингит (n=99), и больных без менингита на фоне дренирования (n=402). При анализе данных о пациентах и заболевании не было выявлено статистически значимых отличий по следующим характеристикам: возраст, пол, а также индекс коморбидности Charlson (p>0,05). Индекс Charlson был предложен специально для оценки прогноза у больных с длительными сроками наблюдения и представляет собой балльную систему оценки возраста (при превышении 50-летнего) и наличия сопутствующих заболеваний [25]. Чем старше пациент и чем более выражена степень органных повреждений, тем выше сумма баллов. По частоте встречаемости дренаж-ассоциированных менингитов в зависимости от характера нейрохирургической патологии достоверных отличий также не было, однако отмечалась тенденция к преобладанию менингитов на фоне НВД у пациентов с сосудистой патологией ЦНС (инсульт, аневризмы и АВМ сосудов головного мозга) (рис. 1).
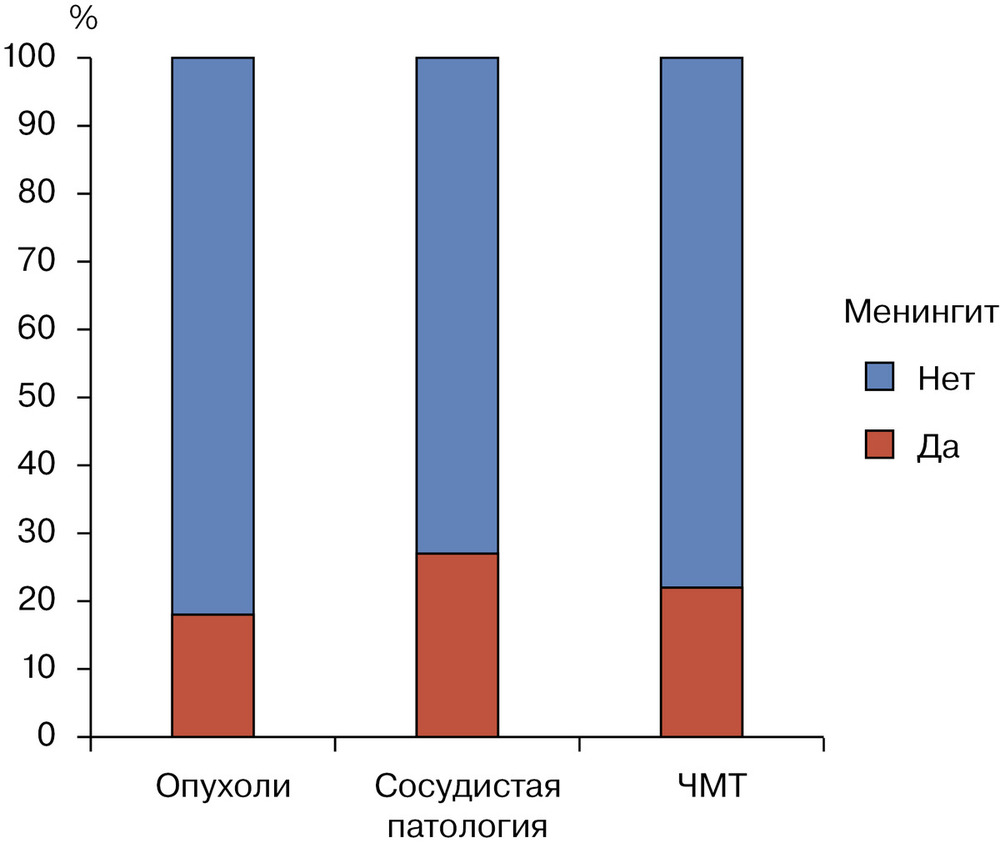
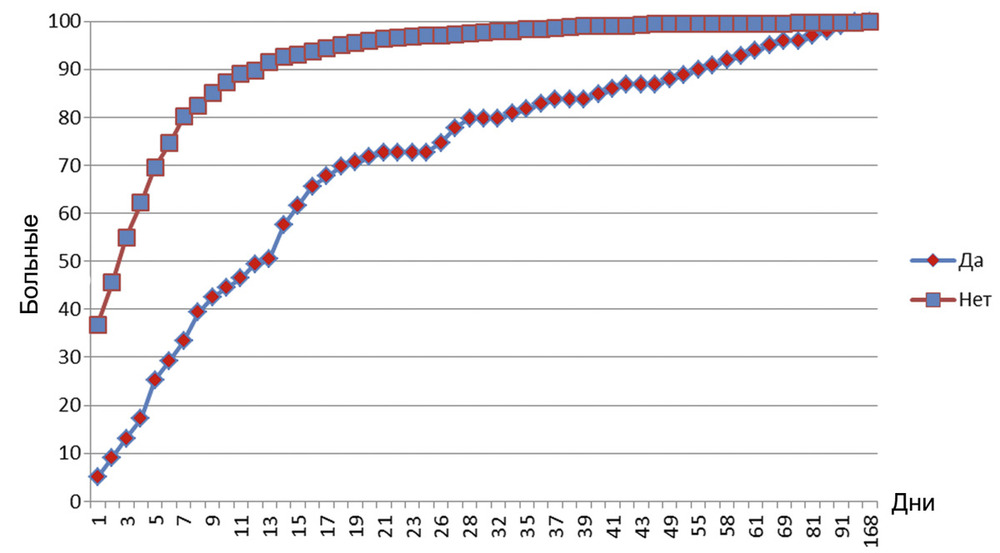
. Необходимость в катетеризации артерии для прямого измерения системного артериального давления (АД) была достоверно выше в группе пациентов с дренаж-ассоциированными менингитами (41,4 и 28,1% соответственно; p<0,05). Подобная корреляция отмечалась и в отношении вазопрессорных препаратов: в случае развития менингита они требовались половине пациентов (50,5%), в то время как без инфекционных осложнений ЦНС медикаментозная поддержка системного АД встречалась только у 36,8% больных (p<0,05). В группе больных с дренаж-ассоциированным менингитом искусственная вентиляция легких (ИВЛ) проводилась у 98 (99%) из 99 пациентов, в то время как в группе без менингитов респираторную поддержку получали 325 (80,8%) больных (p<0,01). По нашему мнению, более частое использование ИВЛ может являться маркером общей тяжести состояния реанимационных пациентов. Именно степень органных повреждений, необходимость использования инвазивных устройств и методик считаются, по данным литературы [26—30], основными факторами риска, существенно повышающими заболеваемость нозокомиальными инфекциями у пациентов ОРИТ. При анализе длительности НВД выявлено достоверно большее (p<0,05) количество дней использования НВД в группе пациентов с дренаж-ассоциированными менингитами. У половины больных без менингита (221 человек, 55%) НВД продолжалось в течение 3 дней, и в целом в этой группе пациентов — не более 12 сут. У половины пациентов с дренаж-ассоциированными менингитами (50 человек, 50,5%) длительность НВД составила не менее 13 дней, а у 90% больных этой же группы — продолжалось до 55 дней (рис. 2).
При анализе сроков развития нозокомиального менингита на фоне НВД были определены два периода повышенной частоты развития дренаж-ассоциированного менингита: на 1—2-е сутки НВД, когда менингит был диагностирован у 20 человек, и 6—7-е сутки, когда менингит был выявлен у 22 пациентов (рис. 3).
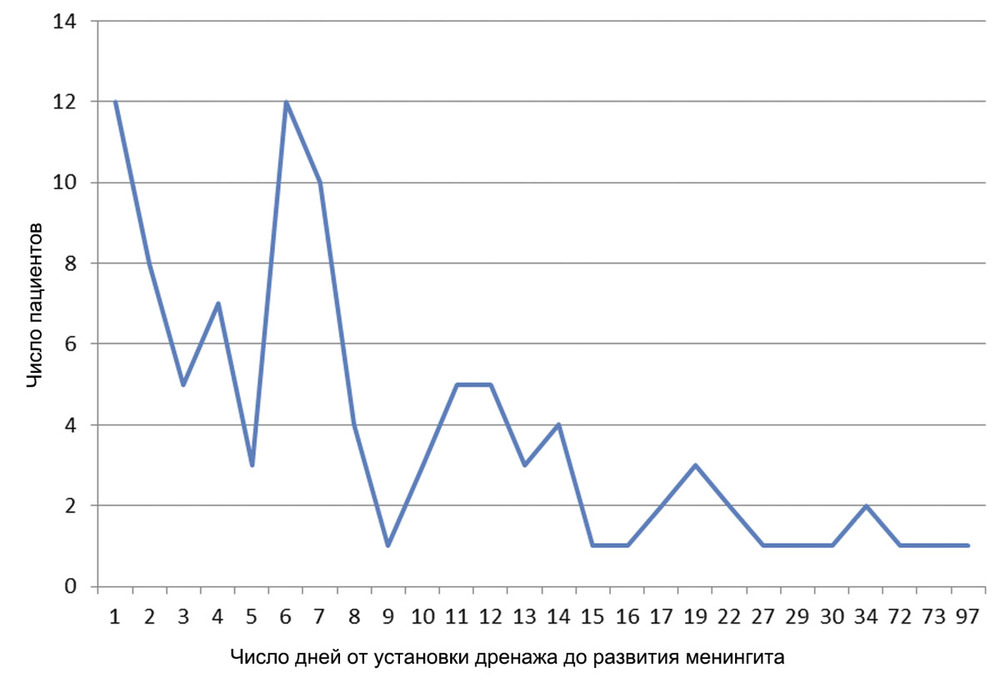
Рис. 3. Число случаев менингита, диагностированного на разных сроках наружного вентрикулярного дренирования. Анализ историй болезни 20 ранних дренаж-ассоциированных менингитов показал: в 8 случаях НВД нейрохирурги устанавливали интраоперационно, в 9 — прикроватно в ОРИТ, у 3 больных манипуляция проводилась в условиях перевязочной нейрохирургического отделения. Таким образом, отсутствуют убедительные данные о связи между риском развития дренаж-ассоциированных менингитов и местом выполнения манипуляции по установке вентрикулярного дренажа. В целом у большинства (57,6%) реанимационных больных дренаж-ассоциированный менингит развился на 1-й неделе дренирования (до 7 сут включительно) (см. рис. 3). Это согласуется с данными литературы, показывающими, что положительная связь между длительностью НВД и риском инфекции более характерна для первой недели использования катетера. В отношении последующих дней НВД полученные разными авторами результаты противоречивы и в общем указывают на то, что со временем риск может снижаться [8, 18], возрастать [6] или оставаться без изменений [11, 13]. При сравнении групп пациентов по наличию или отсутствию ликвореи установлено, что у пациентов с дренаж-ассоциированным менингитом ликворея встречалась достоверно чаще, чем у пациентов с НВД без менингита (41,2 и 17,3% соответственно; p<0,01). В нашем исследовании под термином «ликворея» в подавляющем большинстве случаев (95%) подразумевалась раневая ликворея, к которой относили: ликворею из области послеоперационной раны, ликворею по штифт-каналу вентрикулярного дренажа, назальную ликворею в случае транссфеноидального доступа при эндоскопических операциях.
Этиология дренаж-ассоциированных менингитов по данным микробиологического исследования была установлена у 56 (57,1%) пациентов. В 42 случаях возбудитель инфекции не был установлен, в 4 случаях имела место ассоциация микроорганизмов. В общей сложности выделено 60 микроорганизмов (см. таблицу).
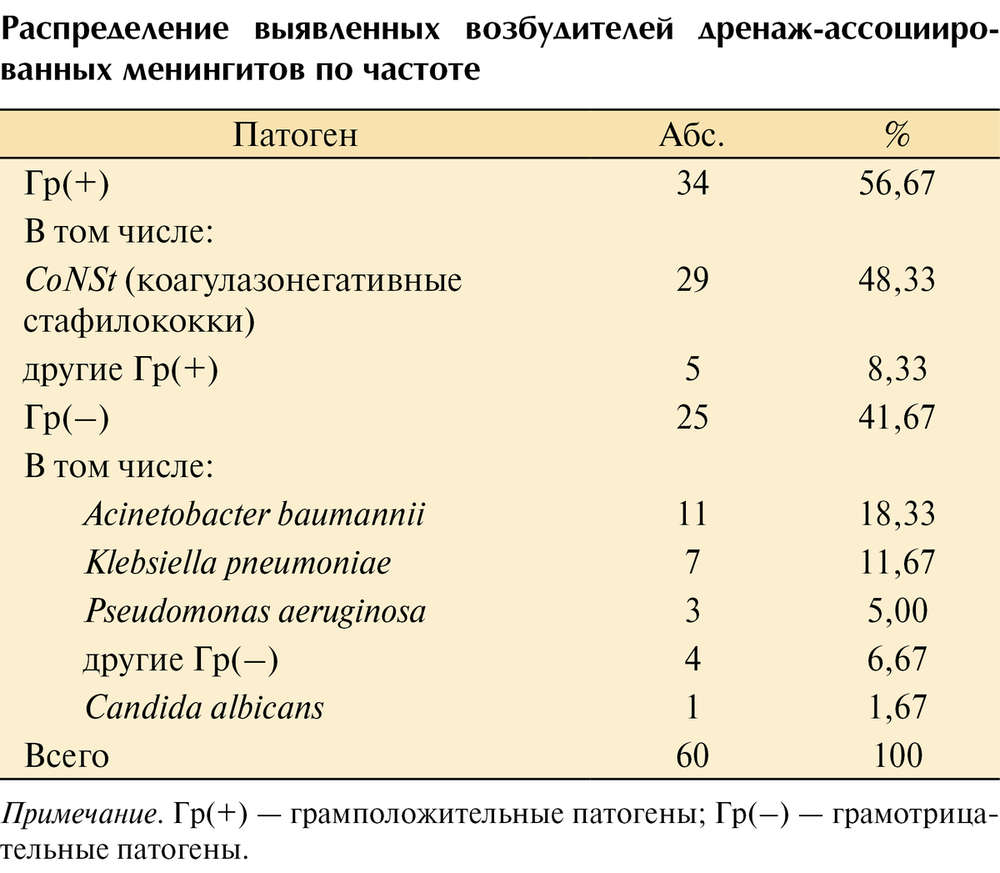
Распределение выявленных возбудителей дренаж-ассоциированных менингитов по частоте Примечание. Гр (+) — грамположительные патогены; Гр (–) — грамотрицательные патогены. В этиологии заболеваний грамположительные патогены составили 56,67% (n=34), грамотрицательные — 41,67% (n=25) и Candida albicans — 1,67% (n=1). Ведущими возбудителями дренаж-ассоциированных менингитов выступили: коагулазонегативные стафилококки (48,3%), Acinetobacter baumannii (18,3%) и Klebsiella pneumoniae (11,7%) (рис. 4).
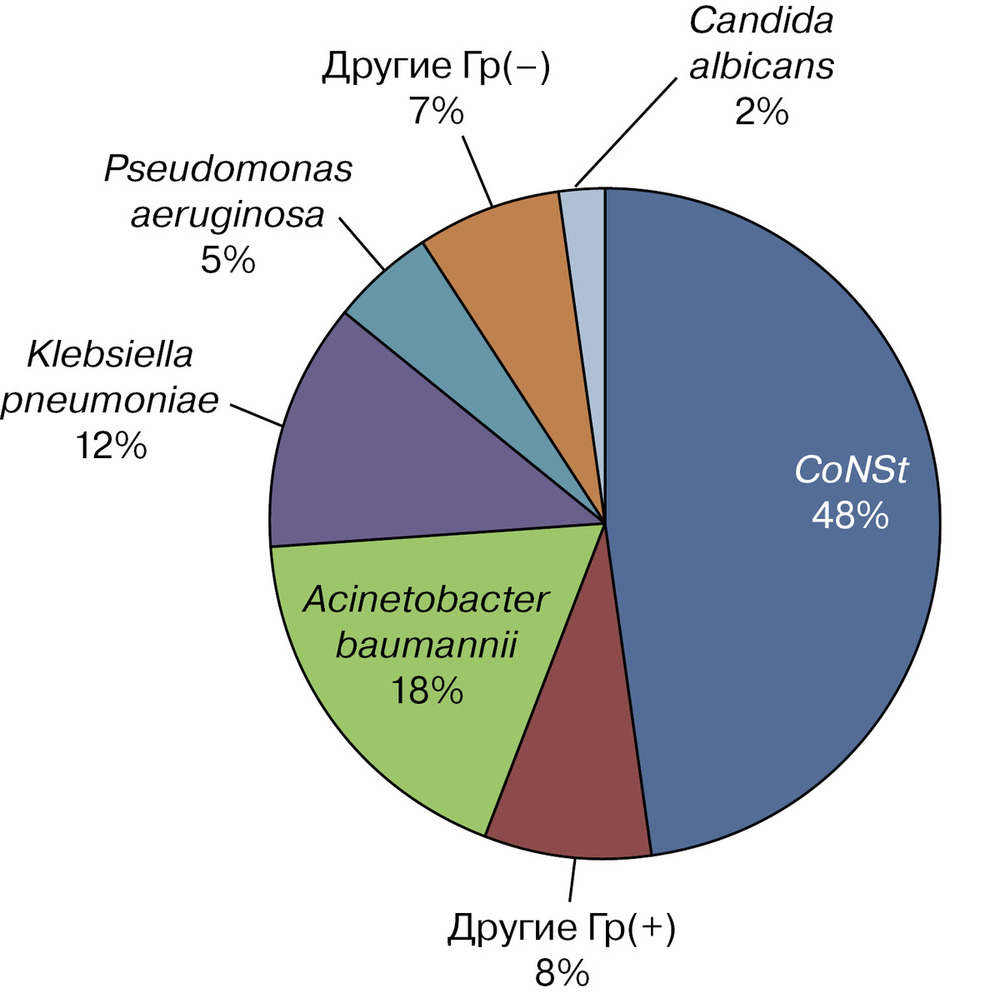
Рис. 4. Представленность патогенов в этиологии дренаж-ассоциированных менингитов. CoNSt — коагулазонегативные стафилококки. Доминирование стафилококков в структуре этиологии инфекционного процесса позволяет предположить в качестве ведущего пути инфицирования ликвора контаминацию поверхности дренажа представителями нормальной микрофлоры кожных покровов, колонизирующих рану входного отверстия дренажа. Показатель общей летальности в ОРИТ ННПЦН за последние 3 года составил 1,7%. Оценка неблагоприятных исходов у пациентов с дренажами проводилась в группе осложненных реанимационных больных, госпитализированных в ОРИТ на период более 48 ч. Доля таких пациентов составляла 14,6% от общего числа поступивших в реанимацию пациентов. Летальность в группе больных с дренаж-ассоциированными менингитами достоверно не отличалась от группы больных с дренажами, но без менингитов (23,2 и 20,2% соответственно; p>0,05), что указывает на разные причины смерти нейрореанимационных больных.
На основании принятого в нашей клинике протокола эмпирической антибактериальной терапии стартовая системная терапия дренаж-ассоциированных менингитов осуществлялась комбинацией карбапенемов (меропенема, дорипенема) и ванкомицина (линезолида) в виде пролонгированной инфузии в максимальной дозировке. Коррекция антимикробной терапии проводилась с учетом антибиотикочувствительности выделенных из ликвора патогенов. При отсутствии высева патогена из ликвора лечение продолжалось эмпирически. Длительность терапии зависела от скорости регресса воспалительных изменений ликвора, снижения маркеров системной воспалительной реакции и составляла в среднем 10—14 дней для грамположительных возбудителей дренаж-ассоциированных менингитов и 14—21 день для грамотрицательных.
Заключение
Наружное вентрикулярное дренирование является общепризнанным фактором риска инфекционных осложнений. В нашем исследовании показатели заболеваемости дренаж-ассоциированными менингитами в популяции осложненных реанимационных больных составили 19,8 на 100 пациентов и 18,3 на 1000 дней дренирования, что соответствует данным других авторов, представленным в литературе.
Среди факторов риска, достоверно повышающих частоту развития дренаж-ассоциированных менингитов, можно выделить те, которые непосредственно связаны с установкой и использованием НВД (длительность дренирования, сочетание с ликвореей) и те, которые выступают показателями общей тяжести состояния больных (показания к ИВЛ, вазопрессорным препаратам, инвазивный мониторинг системного АД). Анализ наших наблюдений показал, что у большинства пациентов (57,6%) дренаж-ассоциированный менингит развивался в 1-ю неделю дренирования. В нашем исследовании менингит достоверно не повышал летальность у пациентов с НВД, находящихся в отделении реанимации. Это свидетельствует о наличии других, не связанных с менингитом факторов, определяющих летальность в популяции осложненных нейрореанимационных больных.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: NKurdumova@nsi.ru
Комментарий
Неоспоримые доказательства роли наружных вентрикулярных дренажей (НВД) как фактора, повышающего риск развития инфекции ЦНС, обусловили выделение дренаж-ассоциированных менингитов (ДАМ) в отдельную группу заболеваний. Между тем широкая вариабельность распространения ДАМ, наряду с проблемами диагностики, требует скрупулезного анализа данных, которыми располагают крупные нейрохирургические клиники, ввиду отсутствия полноценных исследований. В особой степени это касается отечественных нейрохирургических отделений. В этой связи анализ наблюдений развития нозокомиальных инфекционных осложнений ЦНС на фоне применения НВД, рассматривающий 5-летний опыт одного из самых авторитетных нейрохирургических учреждений, выглядит весьма привлекательно. С точки зрения новизны, доказательности и актуальности, статья представляет научный и практический интерес для специалистов.
В.А. Руднов (Екатеринбур)
Список литературы:
- Lyke KE, Obasanjo OO, Williams MA, O’Brien M, Chotani R, Perl TM. Ventriculitis complicating use of intraventricular catheters in adult neurosurgical patients. Clinical Infectious Diseases. 2001;33(12):2028-2033. https://doi.org/10.1086/324492
- Buckwold FJ, Hand R, Hansebout RR. Hospital-acquired bacterial meningitis in neurosurgical patients. Journal of Neurosurgery. 1977;46:494-500. https://doi.org/10.3171/jns.1977.46.4.0494
- Barrett GS, Rammelkamp CH, Worcestor J. Meningitis due to Escherichia coli. Am J Dis Child. 1942;63:41-59. https://doi.org/10.1001/archpedi.1942.02010010042004
- Lundberg N, Troupp H, Lorin H. Continuous recording of the ventricular-fluid pressure in patients with severe acute traumatic brain injury. Journal of Neurosurgery. 1965;22(6):581-590. https://doi.org/10.3171/jns.1965.22.6.0581
- Fried HI, Nathan BR, Rowe AS, Zabramski JM, Andaluz N, Bhimraj A. The insertion and management of external ventricular drains: an evidence-based consensus statement. Neurocrit Care. 2016;24(1):61-81. https://doi.org/10.1007/s12028-015-0224-8
- Mayhall CG, Archer NH, Lamb VA, Spadora AC, Baggett JW, Ward JD, Narayan RK. Ventriculostomy-related infections. N Engl J Med. 1984; 310(9):553-559. https://doi.org/10.1056/nejm198403013100903
- Hoefnagel D, Dammers R, Ter Laak-Poort MP, Avezaat CJJ. Risk factors for infections related to external ventricular drainage. Acta Neurochirurgica. 2008;150(3):209-214. https://doi.org/10.1007/s00701-007-1458-9
- Bota DP, Lefranc F, Vilallobos HR, Brimioulle S, Vincent J-L. Ventriculostomy-related infections in critically ill patients: a 6-year experience. Journal of Neurosurgery. 2005;103(3):468-472. https://doi.org/10.3171/jns.2005.103.3.0468
- Strojnik T, Golc J, Zakelšek J. Infections of external ventricular drainages. Open Medicine. 2013;8(2). https://doi.org/10.2478/s11536-012-0115-8
- Gozal YM, Farley CW, Hanseman DJ, Harwell D, Magner M, Andaluz N, Shutter L. Ventriculostomy-associated infection: a new, standardized reporting definition and institutional experience. Neurocrit Care. 2013;21(1):147-151. https://doi.org/10.1007/s12028-013-9936-9
- Scheithauer SU, Burgel Y-M, Ryang G, Haase J, Schiefer S, Koch H, Hafner, Lemmen S. Prospective surveillance of drain associated meningitis/ventriculitis in a neurosurgery and neurological intensive care unit. Journal of Neurology, Neurosurgery and Psychiatry. 2009;80(12):1381-1385. https://doi.org/10.1136/jnnp.2008.165357
- Holloway KL, Barnes T, Choi S, Bullock R, Marshall LF, Eisenberg HM, Marmarou A. Ventriculostomy infections: the effect of monitoring duration and catheter exchange in 584 patients. Journal of Neurosurgery. 1996;85(3):419-424. https://doi.org/10.3171/jns.1996.85.3.0419
- Korinek A-M, Reina M, Boch AL, Rivera AO, De Bels D, Puybasset L. Prevention of external ventricular drain — related ventriculitis. Acta Neurochirurgica. 2004;147(1):39-46. https://doi.org/10.1007/s00701-004-0416-z
- Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care–associated infection and criteria for specific types of infections in the acute care setting. American Journal of Infection Control. 2008;36(5):309-332. https://doi.org/10.1016/j.ajic.2008.03.002
- Lozier AP, Sciacca RR, Romagnoli MF, Connolly ES. Ventriculostomy-related infections: a critical review of the literature. Neurosurgery. 2002; 51(1):170-182. https://doi.org/10.1097/00006123-200207000-00024
- Lo CH, Spelman D, Bailey M, Cooper DJ, Rosenfeld JV, Brecknell JE. External ventricular drain infections are independent of drain duration: an argument against elective revision. Journal of Neurosurgery. 2007;106(3):378-383. https://doi.org/10.3171/jns.2007.106.3.378
- Hagel S, Bruns T, Pletz MW, Engel C, Kalff R, Ewald C. External ventricular drain infections: risk factors and outcome. Interdisciplinary Perspectives on Infectious Diseases. 2014;1-6. https://doi.org/10.1155/2014/708531
- Ramanan M, Lipman J, Shorr A, Shankar A. A metaanalysis of ventriculostomy-associated cerebrospinal fluid infections. BMC Infectious Diseases. 2015;15(1):3. https://doi.org/10.1186/s12879-014-0712-z
- Rivero-Garvía M, Javier Márquez-Rivas, Jiménez-Mejías M-E, Neth О, Rueda-Torres АВ. Reduction in external ventricular drain infection rate. Impact of a minimal handling protocol and antibiotic-impregnated catheters. Acta Neurochirurgica. 2010;153(3):647-651. https://doi.org/10.1007/s00701-010-0905-1
- Lajcak M, Heidecke V, Haude KH, Rainov NG. Infection rates of external ventricular drains are reduced by the use of silver-impregnated catheters. Acta Neurochirurgica. 2013;155 (5):875-881. https://doi.org/10.1007/s00701-013-1637-9
- Rebuck JA. Infection related to intracranial pressure monitors in adults: analysis of risk factors and antibiotic prophylaxis. Journal of Neurology, Neurosurgery and Psychiatry. 2000;69(3):381-384. https://doi.org/10.1136/jnnp.69.3.381
- Sundbarg G, Nordstrom C-H, Soderstrom S. Complications due to prolonged ventricular fluid pressure recording. Br J Neurosurg. 1988;2(4):485-495. https://doi.org/10.3109/02688698809029603
- Бельский Д.В., Руднов В.А. Нозокомиальный менингит. Клиничес-кая микробиология, антимикробная химиотерапия. 2011;13(2):149-157.
- Курдюмова Н.В., Данилов Г.В., Ершова О.Н., Савин И.А., Соколова Е.Ю., Александрова И.А., Шифрин М.А. Особенности развития внутрибольничных менингитов у пациентов отделения нейрореанимации. Вопросы нейрохирургии. 2015;3:55-59. https://doi.org/10.17116/neiro201579355-59
- Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. Journal of Chronic Diseases. 1987;40(5):373-383. https://doi.org/10.1016/0021-9681(87)90171-8
- Beer R, Lackner P, Pfausler B, Schmutzhard E. Nosocomial ventriculitis and meningitis in neurocritical care patients. Journal of Neurology. 2008;255(11):1617-1624. https://doi.org/10.1007/s00415-008-0059-8
- Ortiz R, Lee K. Nosocomial infections in neurocritical care. Curr Neurol Neurosci Rep. 2006;6(6):525-530. https://doi.org/10.1007/s11910-006-0056-1
- Shulman L, Ost D. Managing infection in the critical care unit: how can infection control make the ICU safe? Critical Care Clinics. 2005;21(1):111-128. https://doi.org/10.1016/j.ccc.2004.10.002
- Vincent J-L. Nosocomial infections in adult intensive-care units. The Lancet. 2003;361(9374):2068-2077. https://doi.org/10.1016/s0140-6736(03)13644-6
- Vincent J-L. International study of the prevalence and outcomes of infection in intensive care units. JAMA. 2009;302(21):2323. https://doi.org/10.1001/jama.2009.1754






