Развитие внутричерепной гипертензии (ВЧГ), т. е. повышение внутричерепного давления (ВЧД) свыше 20 мм рт.ст. длительностью свыше 5 мин, у пострадавших с тяжелой черепно-мозговой травмой (ЧМТ), является основной причиной вторичного поражения головного мозга и неблагоприятных исходов [1—3]. Отек мозгового вещества, возникающий вследствие первичного травматического повреждения головного мозга, является одной из ведущих причин развития ВЧГ среди пострадавших с ЧМТ, наряду с такими факторами, как нарушение венозного оттока, ликвородинамики, ауторегуляции мозгового кровотока, снижение механизмов пространственной компенсации и т. д. [4—7]. Все перечисленные механизмы вносят вклад в формирование вторичных повреждений головного мозга ишемической природы [4, 7—12].
Согласно международным рекомендациям Brain Trauma Foundation [3], а также рекомендациям, принятым Ассоциацией нейрохирургов Российской Федерации [2], инвазивный мониторинг ВЧД показан пострадавшим с ЧМТ, тяжесть состояния которых по шкале комы Глазго (ШКГ) менее 9 баллов, при наличии патологических изменений в головном мозге по данным компьютерной томографии (КТ). При отсутствии патологических изменений на КТ имплантация датчика ВЧД проводится при сочетании любых двух критериев: возраст старше 40 лет, артериальное систолическое давление менее 90 мм рт.ст., наличие познотонических реакций по типу декортикации или децеребрации.
Данные КТ головного мозга, такие как смещение срединных структур более 5 мм, сужение базальных цистерн и конвекситальных субарахноидальных щелей, являются лишь косвенными критериями повышения ВЧД и не могут использоваться для прогнозирования его динамики. Оценка изменений ВЧД, у пострадавших с травматическим поражением головного мозга, возможна лишь при непрерывном измерении с помощью инвазивного датчика ВЧД [6].
Благодаря развитию современных технологий появились мобильные транспортные КТ, что существенно облегчает выполнение этой диагностической процедуры, делает ее возможной даже для нетранспортабельных больных, расширяет возможности неинвазивной оценки ВЧД. Наряду с общепринятыми критериями оценки состояния мозгового вещества и интракраниального содержимого, использование КТ в отделении нейрореанимации позволяет провести измерение диаметра оболочки интраорбитальной части зрительного нерва.
Измерение диаметра оболочки зрительного нерва (ДОЗН) является неинвазивным методом диагностики ВЧГ и может использоваться в качестве дополнительного критерия при решении вопроса об инвазивном измерении ВЧД [13, 14]. Термин «диаметр оболочки зрительного нерва» (optic nerve sheath diameter — ONSD) общепризнан и широко используется в иностранной литературе. При этом оболочку зрительного нерва принимают за цилиндр, который может растягиваться при повышении ВЧД, что приводит к увеличению его диаметра. В работе мы решили использовать дословный перевод термина и соответствующую ему аббревиатуру.
Поскольку интраорбитальные отделы зрительных нервов окружены твердой и арахноидальной оболочками и сообщаются с субарахноидальным пространством головного мозга, повышение ВЧД через повышение ликворного давления передается на подоболочечное пространство зрительного нерва, что приводит к его растяжению и увеличению ДОЗН. Многочисленные экспериментальные и клинические исследования [15—17] показали, что диаметр ДОЗН увеличивается в течение нескольких минут вслед за повышением ВЧД и достигает своего максимального значения при ВЧД 35‒45 мм рт.ст.
Измерение ДОЗН вошло в практику интенсивной терапии пациентов с поражением ЦНС и политравмой и проводится с помощью ультразвукового исследования (УЗИ) [18—20]. Для успешного выполнения этого исследования необходимо соблюдение стандартизированной методики высококвалифицированным специалистом.
Использование МРТ для этих целей также возможно, но, как правило, ограничено тяжестью состояния пациентов, длительностью исследования, необходимостью анестезиологического обеспечения [7]. Показано, что измерения ДОЗН, проведенные на основе КТ и МРТ, хорошо коррелируют между собой [21].
Цель исследования — вычисление корреляции между ДОЗН и значениями ВЧД по данным инвазивного мониторинга, проведение статистического анализа полученных данных.
Материал и методы
Работа представляет собой одноцентровое ретроспективное когортное исследование. Для анализа использовался материал Института (ФГАУ «ННПЦН им. Н.Н. Бурденко» Минздрава России) из проспективно собранной базы данных пострадавших с тяжелой ЧМТ за период с 2004 по 2013 г.
Критериями включения в исследование были: диагноз тяжелой ЧМТ на момент госпитализации (ШКГ 8 баллов и менее), возраст старше 16 лет, госпитализация в Институт в первые 2 сут с момента травмы, а также наличие данных КТ-исследования, выполненного в момент поступления в реанимационное отделение, и данных мониторинга АД, ВЧД за время пребывания в ОРИТ в указанный период времени.
Критерии исключения были: наличие кранио-орбитальной травмы, госпитализация в сроки свыше 2 сут с момента травмы, отсутствие данных нейромониторинга, наличие артефактов на КТ в проекции зрительного нерва, а также наличие краниотомии и декомпрессивной трепанации, признаки базальной ликвореи.
Согласно представленным критериям, в исследование был включен 41 (11 женщин и 30 мужчин) пострадавший с тяжелой ЧМТ (ШКГ 8 баллов и менее). Средний возраст составил 30±11 лет. Всем больным на основании тяжести состояния, клинико-неврологической картины и данных КТ выставлены показания для инвазивного измерения ВЧД.
Распределение пострадавших по ШКГ представлено на рис. 1.
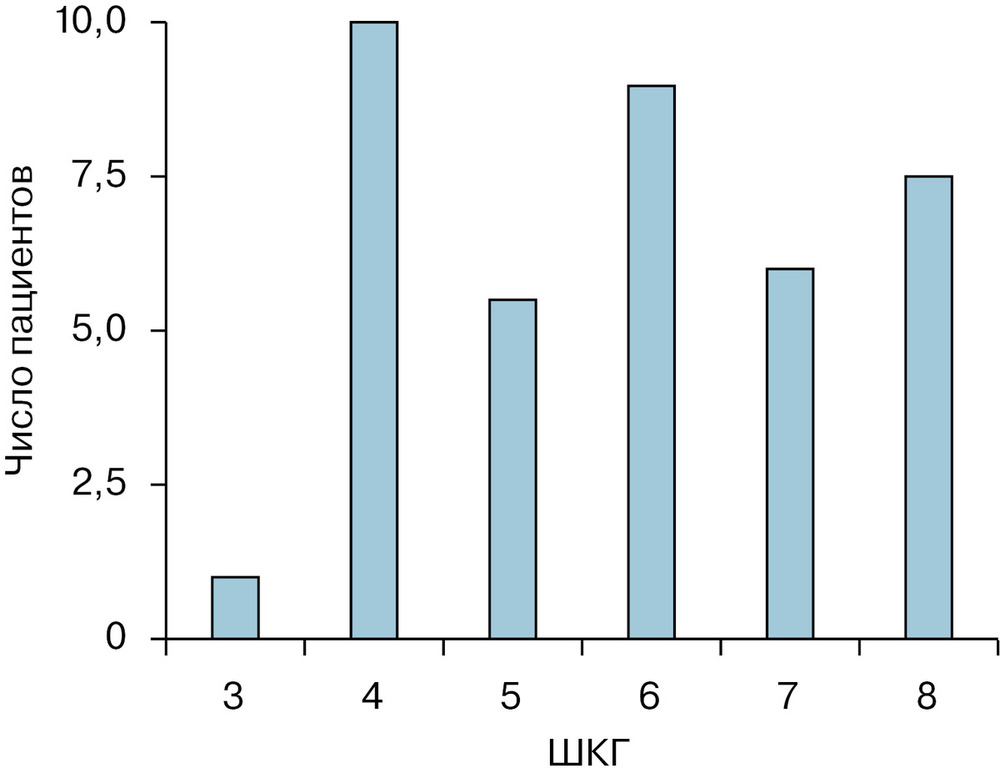
С изолированной ЧМТ было 19 (40%) пострадавших, с закрытой — 16 (33%). При госпитализации в ОРИТ всем пострадавшим выполнялась КТ (CereTom, «Neurologica Danvers MA», США). Сканирование осуществлялось с толщиной среза 2,5 мм. Все пострадавшие находились в отделении реанимации на ИВЛ, проводилась интенсивная терапия в соответствии с международными рекомендациями [3]. Всем пострадавшим измерялось паренхиматозное ВЧД («Codman & Shurtlett, MA», США), средняя длительность мониторинга составила 7±1,7 сут. Датчик ВЧД устанавливался в условиях реанимационного отделения. Датчик имплантировался в белое вещество мозга в премоторную зону по общепринятой методике на глубину 2 см от внутренней костной пластинки через трефинационное отверстие в проекции точки Кохера. Сторона имплантации выбиралась в зависимости от характера повреждения. При диффузном поражении датчик имплантировался в субдоминантное полушарие, при очаговом поражении — со стороны большего повреждения мозгового вещества. Калибровка датчика проводилась, согласно инструкции производителя, на поверхности стерильного физиологического раствора на границе вода—воздух. Данные мониторинга основных параметров (АД, ВЧД) регистрировались с помощью Software ICM+(«Cambridge», Соединенное Королевство), с частотой 100 Гц. Параметры ВЧД, используемые для дальнейшего анализа, представлены в таблице.
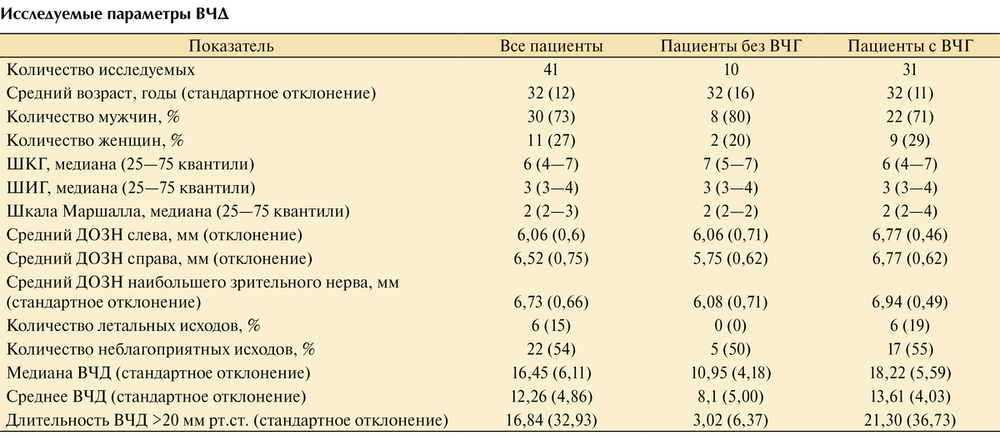
Исследуемые параметры ВЧД
Оценка ДОЗН производилась «вслепую» двумя рентгенологами (Д.А.С. и Т.А.М.). Измерение ДOЗН проводилось с уровнем и шириной окна в диапазоне 25—300 едH. Величина ДОЗН оценивалась на расстоянии 3 мм от заднего контура глазного яблока (рис. 2).
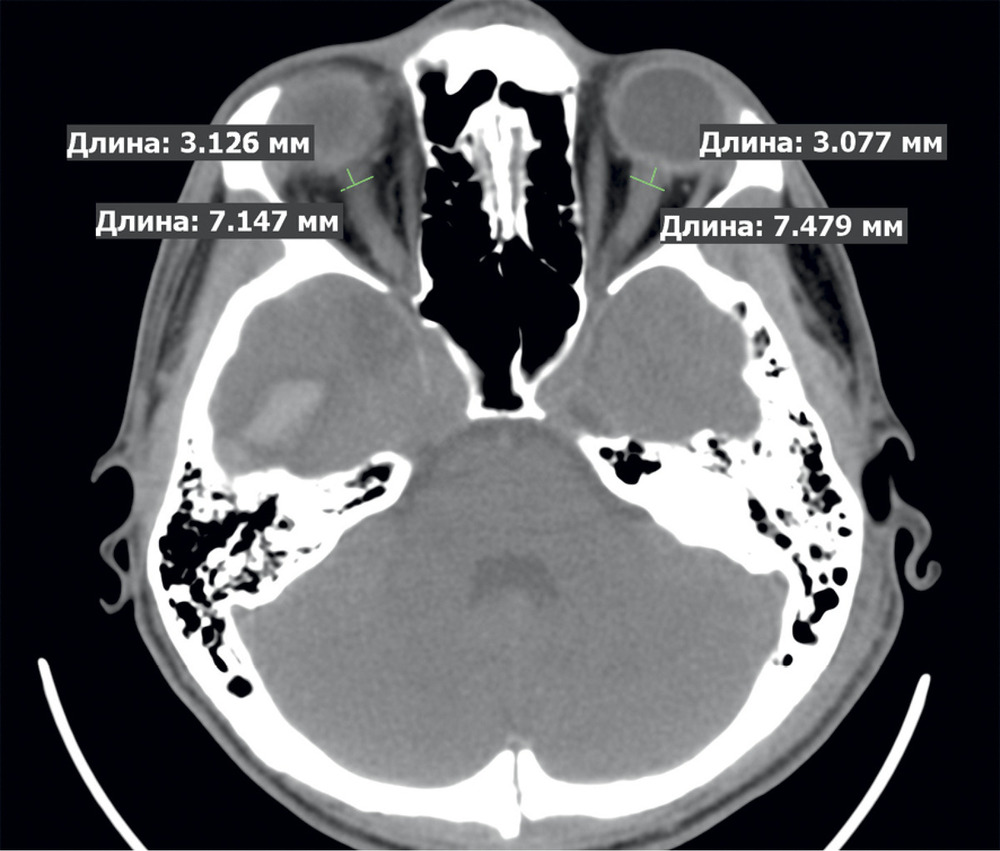
Для дальнейшего статистического анализа выбирали большее из двух измерений ДОЗН. Анализировались только данные первого КТ-исследования с момента госпитализации. На рис. 3 представлена
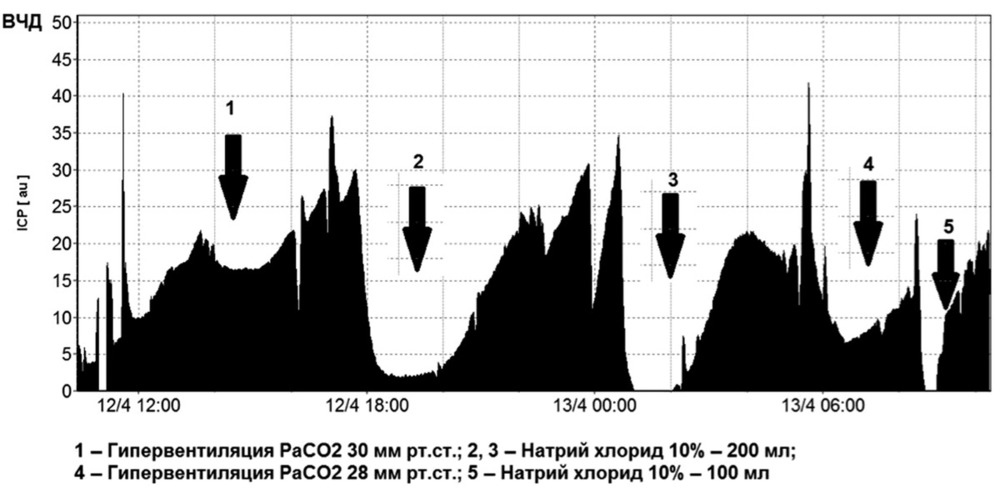
динамика ВЧД у пострадавшего с тяжелой ЧМТ, которому было выполнено КТ (см. рис. 2) и по совокупности клинико-неврологических и нейровизуализационных критериев определены показания для проведения инвазивного измерения ВЧД. Несмотря на то что в момент установки датчика ВЧД было на уровне 5—6 мм рт.ст., в дальнейшем у пострадавшего зафиксированы повторные и многократные эпизоды повышения ВЧД свыше 20 мм рт.ст., которые требовали проведения направленной интенсивной терапии. У каждого пациента с помощью программного обеспечения Software ICM+(«Cambridge», Соединенное Королевство) регистрировались параметры ВЧД, которые использовались для последующего статистического анализа (см. таблицу), в виде среднего, медианного и максимальных значений, а также стандартных отклонений, суммарной длительности ВЧГ (ВЧД >20 мм рт.ст.) за все время мониторинга. По полученным данным проводился корреляционный и ROC-анализ с помощью программного пакета R-project (www.r-project.org).
Всех пациентов разделили на две группы: 1-я — 10 пострадавших с нормальным ВЧД, 2-я — 31 пострадавший с развитием ВЧГ. Для оценки возможности использования ДОЗН в качестве классификатора ВЧГ использовался ROC-анализ. Вычисляемые количественные характеристики ROC-анализа: площадь под кривой (Area Under Curve, AUC), оптимальное пороговое значение и соответствующие значения чувствительности и специфичности. Также при помощи генерации псевдовыборок методом bootstrap-репликаций были вычислены 95% доверительные интервалы для AUC, чувствительности и специфичности.
Результаты
У 31 (76%) из 41 пациента была зарегистрирована суммарная длительность ВЧГ (ВЧД >20 мм рт.ст.) более 1 ч.
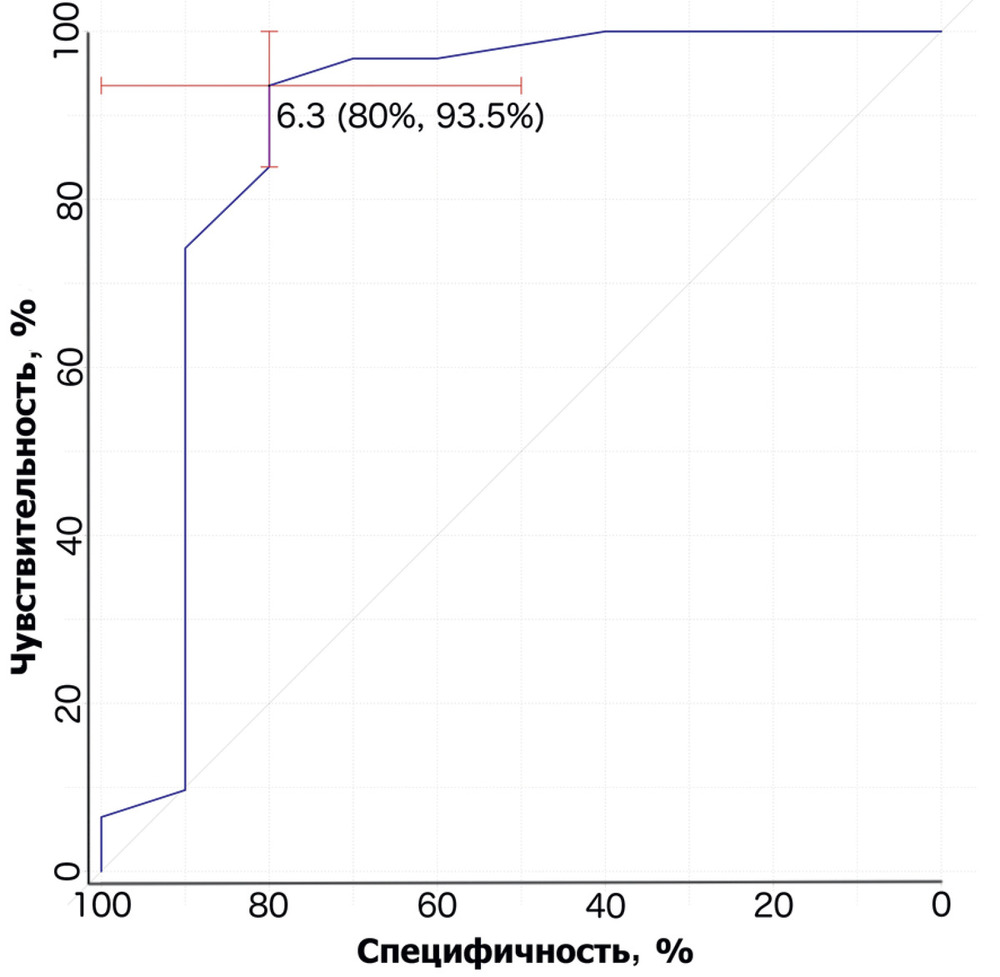
По результатам ROC-анализа для обеих групп больных на основе данных КТ определено пороговое значение ДОЗН, равное 6,35 мм. Это значение ДОЗН соответствует точке с максимальной суммарной чувствительностью 0,93 (95% ДИ 0,84—1,00) и специфичностью 0,80 (95% ДИ 0,50—1,00) и AUC 0,87 (95% ДИ 0,69—1,00) (рис. 4).
Распределение диаметров оболочек зрительных нервов считалось нормальным, так как в тестах Шапиро—Уилка были получены значения p>0,05. Коэффициент корреляции по Пирсону между диаметрами оболочки левого и правого зрительных нервов равен 0,78 (p<0,05, 95% ДИ 0,62—0,88) (рис. 5).
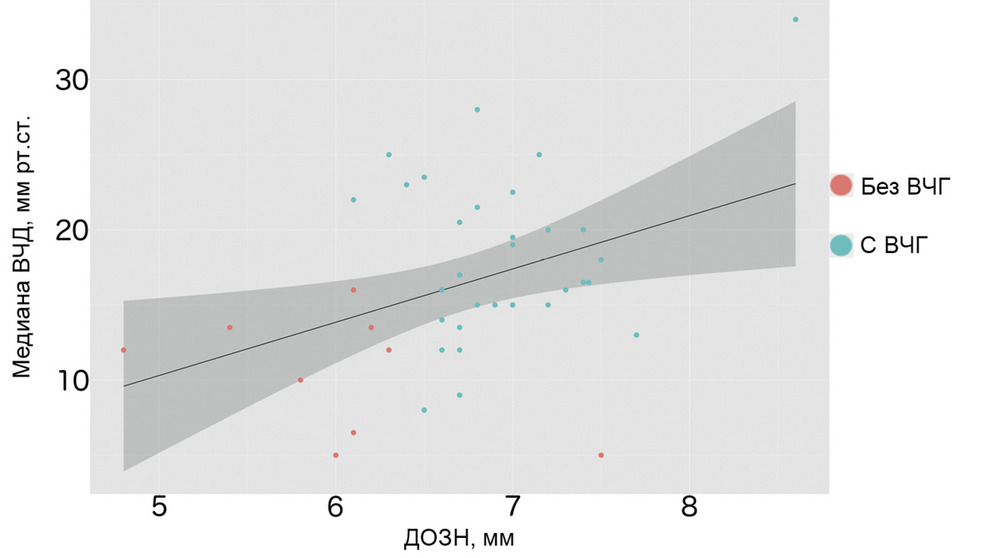
Корреляция по Спирмену между ДОЗН и медианой ВЧД равна 0,32 (95% ДИ 0,02—0,60; p<0,05). В связи с тем что у большинства пациентов из группы с ВЧГ (23 из 31) распределение ВЧД за время мониторинга имело ненормальное распределение при равных корреляционных коэффициентах r=0,32 со средним ВЧД, для дальнейшего анализа мы использовали медиану ВЧД.
Обсуждение
Первые исследования, посвященные изучению динамики ВЧД, были проведены Lundberg в 1960 г., который впервые провел непрерывное измерение ликворного давления в желудочках мозга. В дальнейшем были разработаны и внедрены различные способы инвазивного измерения ВЧД: в субарахноидальном и субдуральном пространствах, в паренхиме головного мозга. Каждый из этих методов имеет свои преимущества и недостатки [22, 23].
Установка датчика интракраниального давления любого типа является хирургическим вмешательством и сопряжена с развитием геморрагических и инфекционных осложнений, а также с проблемой дрейфа «нулевого значения» ВЧД [24]. Существует ряд неинвазивных методик, позволяющих косвенно судить о наличии ВЧГ: количественная папиллометрия, офтальмодинамометрия, оценка выбухания барабанной перепонки, измерение ДОЗН (разными методами), транскраниальная допплерография, МРТ, КТ [25].
По данным литературы [26], точное измерение ДОЗН можно произвести с помощью ультразвукового исследования или МРТ, причем величины, полученные этими методами, хорошо сопоставимы между собой. Данные, полученные методами МРТ и КТ, также хорошо коррелируют [21]. В случае тяжелой ЧМТ основным первичным диагностическим методом и, в отличие от УЗИ, оператор-независимым методом исследования является КТ.
Увеличение ДОЗН при повышении ВЧД связано с особенностями строения зрительного нерва. При повышении ВЧД на фоне истощения механизмов пространственной компенсации происходит перераспределение ликвора из интракранильных в экстракраниальные пространства, что сопровождается растяжением оболочек зрительного нерва и увеличением ДОЗН. Эти изменения наиболее выражены в дистальной трети зрительного нерва, ближе к глазному яблоку [15]. Экспериментальным путем было показано, что наиболее податливая часть оболочки зрительного нерва расположена в области его ампулярной части, поэтому общепринято проводить оценку ДОЗН на расстоянии 3 мм от задней стенки глазного яблока [16]. Нормальные значения ДОЗН на этом участке по данным КТ были вычислены при исследовании у 300 пациентов без клинических и рентгенологических признаков ВЧГ. По результатам исследования значения ДОЗН находились в пределах от 4,94±1,51 до 5,17±1,34 мм [27].
Измерения ДОЗН, проведенные на основе МРТ, показали, что при диаметре менее 5,3 мм развитие ВЧГ маловероятно, тогда как при диаметре ДОЗН более 5,82 мм вероятность развития ВЧГ составляет 90% [20].
M. Sekhon и соавт. [14] выявили хорошую корреляцию межу ДОЗН и значениями ВЧД при тяжелой ЧМТ в остром периоде. Используя значение 6 мм как пороговое, авторы получили площадь под кривой AUC=0,83 (95% ДИ 0,73‒0,94) с истинно положительным значением в 67% случаев, ложноположительным — в 92%. Авторы сделали вывод, что измерение ДОЗН по данным КТ является более точным критерием развития ВЧГ (R2=0,56) по сравнению с такими признаками на КТ (R2=0,21), как компрессия боковых желудочков, сглаженность границы белого и серого вещества, латеральная дислокация свыше 5 мм, компрессия базальных цистерн. Ими же было показано, что внутрибольничная смертность удваивается с увеличением ДОЗН на 1 мм (отношение вероятностей наступления и ненаступления события, отношение шансов (ОШ) 2,0, 95% ДИ 1,2—3,2; р=0,007). Наши результаты корреляции ДОЗН и ВЧД достаточно близки к данным M. Sekhon и соавт. [14], так как исследования были проведены на схожих группах пациентов, в ранние сроки с момента травмы и сопоставлялись с анализом инвазивного измерения ВЧД.
Несмотря на полученные результаты, согласные с данными других авторов, хотим отметить ряд важных моментов, которые следует учитывать в клинической практике.
Во-первых, КТ — это скрининговый метод диагностики, который дает информацию о состоянии травмированного мозга и прилежащих тканей в конкретный промежуток времени.
Во-вторых, мы проанализировали ограниченное число пациентов (41 пациент), которые поступили в институт в первые 48 ч с момента травмы. По данным литературы [28], именно в этот период существует максимальный риск развития ВЧГ на фоне травматического повреждения головного мозга и формирования отека мозга. Соответственно мы не исключали того, что часть пострадавших могли перенести ВЧГ до момента госпитализации и начала инвазивной регистрации ВЧД. Напоминаем, что все пациенты имели тяжелую ЧМТ и находились в коме, что свидетельствует о тяжести первичного повреждения мозга и соответственно высокой вероятности ВЧГ. Следовательно, у части пациентов уже на момент госпитализации могла быть перерастянутая оболочка зрительных нервов с соответствующими высокими значениями ДОЗН. Именно этим фактом мы можем объяснить невысокую, но достоверную корреляцию ВЧД и ДОЗН, которая была меньше, чем в исследованиях Sekhon и соавт. (r=0,7).
Согласно данным литературы [15, 16], ДОЗН достаточно динамичная величина, способная быстро увеличиваться вслед за повышением ВЧД. Длительная экспозиция ВЧД свыше 35—55 мм рт.ст. может способствовать перерастяжению оболочек, которое может в дальнейшем сохраняться даже при нормализации ВЧД. В нашей работе мы сравнивали только ДОЗН в момент госпитализации с параметрами инвазивного измерения ВЧД (максимальным, средним, медианным). Предварительный анализ показал, что значения ДОЗН достоверно коррелировали с медианным и средним значениями ВЧД, но поскольку у большинства пациентов было ненормальное распределение ВЧД, для анализа мы выбрали медианные значения. Низкий коэффициент корреляции между ДОЗН и медианой ВЧД, по нашему мнению, может также объясняться «зашумленностью» ВЧД (рис. 3).
В-третьих, задачей нашего ретроспективного исследования была оценка корреляционной связи между ДОЗН и ВЧД, которую нам удалось решить. Дополнительно нами оценивалось пороговое значение для ДОЗН, которое на практике, возможно, позволит клиницисту выделить группу пациентов с уже перенесенной ВЧГ, либо с ВЧГ, которая развилась в момент выполнения КТ-исследования, либо, что имеет особое значение, с высокой вероятностью развития ВЧГ после КТ в ближайшей перспективе. Хотим отметить, что значения ДОЗН в группе больных с ВЧГ (табл. 1) значительно превосходили таковые в группе с нормальным ВЧД. По нашим данным, у 76% исследуемых развилась ВЧГ с суммарной длительностью свыше 1 ч, даже несмотря на полный комплекс профилактических и лечебных мероприятий в соответствии с принятыми рекомендациями. По нашему мнению, превышение порогового значения ДОЗН на момент первичного обследования пострадавших с тяжелой ЧМТ может быть дополнительным показанием к инвазивному измерению ВЧД, поскольку может указывать как на вероятность перенесенной ВЧГ, так и на развитие ВЧГ в перспективе.
Однако следует отметить, что интерпретация показателя ДОЗН может быть затруднена при ликворее, кранио-орбито-фациальной травме, после краниотомии, дренирования желудочковой системы.
Выводы
Выявлена корреляционная зависимость между КТ-параметром ДОЗН и медианным значением ВЧД у пострадавших с тяжелой ЧМТ с коэффициентом корреляции 0,32 (p<0,05). Пороговое значение ДОЗН составило 6,35 мм, с чувствительностью 0,93 (95% ДИ 0,84—1,00), специфичностью 0,80 (95% ДИ 0,50—1,00) и AUC 0,87 (95% ДИ 0,69—1,00).
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: turkin@nsi.ru
Комментарий
Одной из важнейших проблем в нейрохирургии и нейрореаниматологии, возникающих при лечении больных с тяжелой черепно-мозговой травмой (ЧМТ), связанной как с первичными травматическими повреждениями мозга, так и со вторичными изменениями и последующим отеком головного мозга, нарушением перфузионных параметров, ликвородинамическими нарушениями, является внутричерепная гипертензия, которая требует проведения комплекса индивидуальных лечебных мероприятий.
Постоянное стремление в медицине к снижению степени инвазивности как в лечебной, так и диагностической практике на любом этапе ведения больного, нашло свое отражение в данной работе. Компьютерная томография давно вышла за рамки стационарных диагностических подразделений, и мобильные и компактные КТ-аппараты широко применяются в операционных и реанимации.
В статье анализируются ретроспективные данные измерения диаметра оболочек зрительного нерва (ДОЗН) по данным КТ у 41 пациента в остром периоде ЧМТ (в течение 2 сут после травмы) и оценивается их корреляция с результатами инвазивного измерения внутричерепного давления (ВЧД) паренхиматозным датчиком.
Актуальность методики заключается в том, что по результатам измерения ДОЗН при КТ можно косвенно судить о наличии внутричерепной гипертензии у пострадавшего, не прибегая к инвазивному измерению ВЧД, что, естественно, снижает количество осложнений. В зарубежной литературе публикаций, посвященных этой теме, достаточно много, но мало — в отечественной. Слабая распространенность данной методики связана в числе прочего с тем, что внутричерепное давление — весьма лабильный показатель.
Авторы справедливо отмечают, что в остром периоде ЧМТ ВЧД может варьировать в весьма широких пределах, тогда как диаметр оболочки зрительного нерва является, по-видимому, более инертным показателем внутричерепной гипертензии. Возможны ситуации, когда у пациента в анамнезе уже имелась клиника пониженного внутричерепного давления, а ДОЗН остается увеличенным.
В статье авторы рассматривают случаи, когда у пациента в силу анатомических особенностей или расовой принадлежности исходно без ЧМТ имеются увеличенные зрительные нервы с широкими периневральными пространствами. Хотя это не относится к тематике данной работы, было бы интересно рассмотреть вопрос динамики восстановления оболочек зрительного нерва после нормализации внутричерепного давления.
В целом работа представляется интересной и актуальной, хорошо оформлена, содержит результаты корреляционного анализа. Статья может быть полезна нейрорадиологам, нейрохирургам и, конечно, реаниматологам. Начинающие свою практическую деятельность реаниматологи могут почерпнуть важные для себя сведения о разнообразных формах неинвазивного контроля изменений внутричерепного давления. Небезынтересной покажется она и нейрофизиологам, изучающим особенности ликвородинамики у пациентов с интракраниальными поражениями.
М.Б. Долгушин (Москва)
Список литературы:
1 Коновалов А.Н., Потапов А.А., Лихтерман Л.Б. Черепно-мозговая травма. Клиническое руководство в 3 т. М. 1998-2002.
2 Потапов А.А., Крылов В.В., Гаврилов А.Г., Кравчук А.Д., Лихтерман Л.Б., Петриков С.С., Талыпов А.Э., Захарова Н.Е., Ошоров А.В., Сычев А.А., Александрова Е.В., Солодов А.А. Рекомендации по диагностике и лечению тяжелой черепно-мозговой травмы. Часть 2. Интенсивная терапия и нейромониторинг. Вопросы нейрохирургии им. Н.Н. Бурденко. 2016; 80(1): 98‒106. [Potapov AA, Krylov VV, Gavrilov AG, Kravchuk AD, Likhterman LB, Petrikov SS, Talypov AE, Zakharova NE, Oshorov AV, Sychev AA, Alexandrova EV, Solodov AA. Guidelines for diagnostics and treatment of severe traumatic brain injury. Part 2. Intensive care (treatment) and neuromonitoring. Jurnal Voprosy Neirokhir N.N. Burdenko.2016;80(1):98-106. (In Rus)] https://doi.org/10.17116/neiro201680198-106
3 Сarney N, Totten AM, OʼReilly C, Ullman JS, Hawryluk GW, Bell MJ, Bratton SL, Chesnut R, Harris OA, Kissoon N, Rubiano AM, Shutter L, Tasker RC, Vavilala MS, Wilberger J, Wright DW, Ghajar J. Guidelines for the management of severe traumatic brain injury, 4th ed. Neurosurgery. 2016;80(1):6-15. https://doi.org/10.1227/NEU.0000000000001432
4 Потапов А.А. Патогенез и дифференцированное лечение очаговых и диффузных повреждений головного мозга: Дис. … д-ра мед. наук. М. 1989.
5 Лихтерман Л.Б., Потапов А.А., Кравчук А.Д. Современные подходы к диагностике и лечению черепно-мозговой травмы и ее последствий. Вопросы нейрохирургии им. Н.Н. Бурденко. 1996;1:35-37. PMID: 8711970
6 Потапов А.А., Захарова Н.Е., Пронин И.Н., Корниенко В.Н., Гаврилов А.Г., Кравчук А.Д., Ошоров А.В., Сычев А.А., Зайцев О.С., Фадеева Л.М., Такуш С.В. Прогностическое значение мониторинга внутричерепного и церебрального перфузионного давления, показателей регионарного кровотока при диффузных и очаговых повреждениях мозга. Вопросы нейрохирургии им. Н.Н. Бурденко. 2011;75,(3):3-18. PMID: 22066252
7 Zakharova N, Kornienko V, Potapov A, Pronin I. Neuroimaging traumatic brain injury. Neuroimaging of Traumatic Brain Injury. 2014;1-159.
8 Лихтерман Л.Б., Потапов А.А., Кравчук А.Д., Охлопков В.А. Клиническая классификация и концептуальные подходы к лечению последствий черепно-мозговой травмы. Вопросы нейрохирургии им. Н.Н. Бурденко. 1999;3:3.
9 Потапов А.А., Захарова Н.Е., Корниенко В.Н., Пронин И.Н., Александрова Е.В., Зайцев О.С., Лихтерман Л.Б., Гаврилов А.Г., Данилов Г.В., Ошоров А.В., Сычев А.А., Полупан А.А. Нейроанатомические основы травматической комы: клинические и магнитно-резонансные корреляты. Вопросы нейрохирургии им. Н.Н. Бурденко. 2014;78(1):4-13. PMID: 24761591
10 Eisenberg HM, Frankowski RF, Contant CF, Marshall LF, Walker MD. High dose barbiturate control of elevated intracranial pressure in patients with severe head injury. J Neurosurg. 1988;69:15-23. https://doi.org/10.3171/jns.1988.69.1.0015
11 Gjerris F, Brennum J. The cerebrospinal fluid, intracranial pressure and herniation of the brain. In: Paulson OB, Gjerris F, Sørensen PS, eds. Clinical neurology and neurosurgery. Copenhagen: FADL’s Forlag Aktieselskab. 2004;179-196.
12 Marmarou A, Anderson RL, Ward JD, Choi SC, Young HF, Eisenberg HM, Foulkes MA, Marshall LF, Jane JA. Impact of ICP instability and hypotension on outcome in patients with severe head trauma. J Neurosurg. 1991;66:883-890.
13 Kimberly HH, Noble VE. Using MRI of the optic nerve sheath to detect elevated intracranial pressure. Crit Care. 2008;12:181. https://doi.org/10.1186/cc7008
14 Sekhon MS, Griesdale DE, Robba S, McGlashan N, Needham E, Walland K, Shook AC, Smielewski P, Czosnyka M, Gupta AK, Menon DK. Optic nerve sheath diameter on computed tomography is correlated with simultaneously measured intracranial pressure in patients with severe traumatic brain injury. Intensive Care Med. 2014;40:1267-1274. https://doi.org/10.1007/s00134-014-3392-7
15 Helmke K, Hansen HC. Fundamentals of transorbital sonographic evaluation of optic nerve sheath expansion under intracranial hypertension II. Patient study. Pediatr Radiol. 1996;26:706-710.
16 Hansen HC, Helmke K. Validation of the optic nerve sheath response to changing cerebrospinal fluid pressure: ultrasound findings during intrathecal infusion tests. J Neurosurg. 1997;87:34-40. https://doi.org/10.3171/jns.1997.87.1.0034
17 Launey Y, Nesseler N, Le Maguet P, Mallédant Y, Seguin P. Effect of osmotherapy on optic nerve sheath diameter in patients with increased intracranial pressure. J Neurotrauma. 2014;31:984-988. https://doi.org/10.1089/neu.2012.2829
18 Tayal VS, Neulander M, Norton HJ, Foster T, Saunders T, Blaivas M. Emergency department sonographic measurement of optic nerve sheath diameter to detect findings of increased intracranial pressure in adult head injury patients. Ann Emerg Med. 2007;49:508-514. https://doi.org/10.1016/j.annemergmed.2006.06.040
19 Rajajee V, Vanaman M, Fletcher JJ, Jacobs TL. Optic nerve ultrasound for the detection of raised intracranial pressure. Neurocrit Care. 2011;15:506-515. https://doi.org/10.1007/s12028-011-9606-8
20 Geeraerts T, Launey Y, Martin L, Pottecher J, Vigué B, Duranteau J, Benhamou D. Ultrasonography of the optic nerve sheath may be useful for detecting raised intracranial pressure after severe brain injury. Intensive Care Med. 2007;33:1704-1711. https://doi.org/10.1007/s00134-007-0797-6
21 Kalantari H, Jaiswal R, Bruck I, Matari H, Ghobadi F, Weedon J, Hassen GW. Correlation of optic nerve sheath diameter measurements by computed tomography and magnetic resonance imaging. Am J Emerg Med. 2013;31:1595-1597. https://doi.org/10.1016/j.ajem.2013.07.028
22 Zhong J, Dujovny M, Park HK, Perez E, Perlin AR, Diaz FG. Advances in ICP monitoring techniques. Neurol Res. 2003;25:339‒350. https://doi.org/10.1179/016164103101201661
23 Ошоров А.В. Мониторинг церебрального перфузионного давления и ауторегуляции мозгового кровотока при интенсивной терапии тяжелой черепно-мозговой травмы: Дис... д-ра мед. наук. М. 2016.
24 Saladino A, White JB, Wijdicks EF, Lanzino G. Malplacement of ventricular catheters by neurosurgeons: A single institution experience. Neurocrit Care. 2009;10:248-252. https://doi.org/10.1007/s12028-008-9154-z
25 Sahu S, Swain A. Optic nerve sheath diameter: A novel way to monitor the brain. J Neuroanaesthesiol Crit Care. 2017;4:13-18. https://doi.org/10.4103/jnacc.jnacc_73_16
26 Bäuerle J, Schuchardt F, Schroeder L, Egger K, Weigel M, Harloff A. Reproducibility and accuracy of optic nerve sheath diameter assessment using ultrasound compared to magnetic resonance imaging. BMC Neurol. 2013;13:187. https://doi.org/10.1186/1471-2377-13-187
27 Vaiman M, Abuita R, Bekerman I. Optic nerve sheath diameters in healthy adults measured by computer tomography. Int J Ophthalmol. 2015;8:1240-1244. https://doi.org/10.3980/j.issn.2222-3959.2015.06.30
28 Miller JD, Becker DP, Ward JD, Sullivan HG, Adams WE, Rosner MJ. Significance of intracranial hypertension in severe head injury. J Neurosurg. 1977;47(4):503-516. https://doi.org/10.3171/jns.1977.47.4.0503






