Резюме
В приведенной работе, на основании данных современной литературы представлены основные физиологические и патофизиологические аспекты измерения ВЧД, обсуждены показания для мониторинга ВЧД и его клиническое значение.
Введение
Лечение больных с острыми церебральными повреждениями почти всегда представляет серьезную проблему и, прежде всего из-за особенностей интракраниальной системы, расположенной в замкнутой герметичной полости черепа с фиксированным объемом. Патогенез и танатогенез больных с церебральными повреждениями изучен в настоящее время достаточно полно. Результат этого изучения однозначно показал ведущую роль синдрома острой внутричерепной гипертензии (ВЧГ). Важность количественной оценки значений давления в полости черепа для больных с церебральной патологией в настоящее время не вызывает сомнений. Более того, человечество прошло определенный путь и в методологическом аспекте, разработав различные методы измерения ВЧД. Настоящая работа посвящена, прежде всего, таким аспектам как методология измерения ВЧД и его клиническому значению.
История измерения ВЧД.
Первую попытку измерения внутричерепного давления (ВЧД) методом люмбальной пункции произвел в 1897 Quincke [8]. Первое направленное нейрохирургическое вмешательство по результатам измерения ВЧД было выполнил Sharpe W. в 1920 [61]. Автор определил показания для выполнения подвисочной декомпрессивной краниоэктомии при развитии внутричерепной гипертензии.
В начале XX века многие клиницисты производили измерение ВЧД при люмбальной пункции и использовали показатели ликворного давления для диагностики внутричерепной гипертензии и в качестве ориентира для последующей терапии. В то же время были отмечены расхождения между клиникой заболевания и показателями ликворного давления. Так в ряде случаев регистрировалась дислокационная симптоматика или клиника внутричерепной гипертензии при отсутствии высоких значений ликворного давления в люмбальном пространстве.
Объяснение данному феномену дал в 1964 году Langfitt [37]. Он провел одновременную регистрацию давления в люмбальном и интракраниальном пространствах и установил разницу давлений в двух пространствах. Langfitt отмечал существование градиента давлений между ликворными пространствами при наличии объемного образования выше или ниже намета мозжечка, вызывающего сдавление ликворных путей. Langfitt установил, что у метода есть четкое ограничение и его надо учитывать: должна быть сохранена проходимость ликворных [37].
Первое непрерывное измерение ВЧД (мониторинг) произвел в 1950 году Pierre Janny [32]. Однако работа его была опубликована только в 1972 году [33]. Поэтому пионером в мониторинге ВЧД считается Nils Lundberg, который в 1960 году опубликовал свою работу “Continuous recording and control of ventricular fluid pressure in neurosurgical practice” [38]. Анализируя тренды ВЧД, Lundberg выделил разные типы волн ВЧД: А, В, и С - волны. Наиболее значимые волны которые мы встречаем в своей практике это А - волны или плато-волны. Название волны получили за характерную форму. А - волны достигают по амплитуде до 50 - 100 мм рт.ст. и бывают длительностью от 5 мин и более. Плато-волны формируются при дилатации церебральных сосудов головного мозга. Основной причиной данного феномена может быть снижение церебрального перфузионного давления, снижения системного артериального давления или гиперкапния. Плато-волны сопровождаются критическим снижением церебрально-перфузионного давления (ЦПД), что может вызывать ишемию головного мозга [78]. Доказано, что появление плато-волн указывает на сохранную церебральную ауторегуляцию и является показателем сниженной эластичности (elastance) головного мозга. Так как плато-волны формируются только при наличии ауторегуляции мозговых сосудов, то для их устранения достаточно провести гипервентиляцию и запустить вазоконстрикторный каскад, повысив АД и ЦПД.
Волны В и С не имеют важного клинического значения. В - волны могут трансформироваться в плато-волны. Проведенное исследование Castellani G. и соавт показало, что плато-волны чаще регистрируются у пострадавших с ЧМТ молодого возраста, чаще при закрытой ЧМТ, минимальном объеме контузионного очага, небольшой латеральной дислокации срединных структур по данным компьютерной томографии (КТ). [14]. Согласно выводам группы авторов, наличие плато-волн при ЧМТ является прогностически благоприятным признаком, так как свидетельствует о сохранности ауторегуляции мозговых сосудов. Важно помнить, что плато-волны необходимо своевременно устранять из-за риска развития церебральной ишемии [14, 78].Патофизиологические аспекты измерения ВЧД.
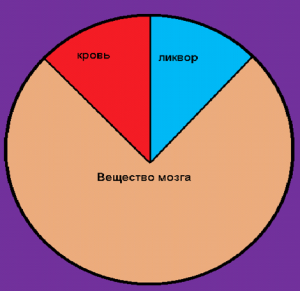
В основе измерения ВЧД лежит доктрина Монро- Келли, которая гласит:- все внутричерепные объемы заключены в ригидном костном образовании – полости черепа и суммарный объём внутричерепных компонентов (кровь, ликвор и мозговое вещество) остается постоянным; - при появлении дополнительного объемного компонента (опухоль, гематома, отек) или изменении объема любого из перечисленных трех, суммарный объем должен оставаться неизменным; - объёмное равновесие между компонентами интракраниальной системы обеспечивает постоянство давления в полости черепа. Другими словами, компенсация прироста объема одного из компонентов должна быть обеспечена пропорциональным уменьшением объема одного или двух других компонентов. Внутричерепными компонентами, обеспечивающими объемное равновесие, являются ликвор и венозный компонент внутричерепного объема крови. Нарушение объемного равновесия приводит к повышению ВЧД. Диагностическая ценность измерения ВЧД заключается в том, что позволяет судить о состоянии объемной компенсации в полости черепа.Математически доктрину Монро - Келли можно выразить формулой:V = Vкровь + Vликвор + Vмозг,илиV = ΔVпат +. ΔVкровь + ΔVликвор +ΔVмозг,где V – суммарный объем крови, ΔV – изменении объема внутричерепных компонентов.
Доктрина Монро - Келли может быть представлена схематично (рис.1 - Схема Доктрины Монро-Келли. Внутричерепное содержимое: мозговое вещество, кровь, ликвор.). Мозговое вещество составляет 80-85% интракраниального объема или 1200-1600 мл: нейроны 500-700 мл, глия 700-900 мл, внеклеточная жидкость до 75 мл. Кровь и ликвор суммарно составляют 15-20% интракраниального объема, т.е. приблизительно по 100-150 мл.
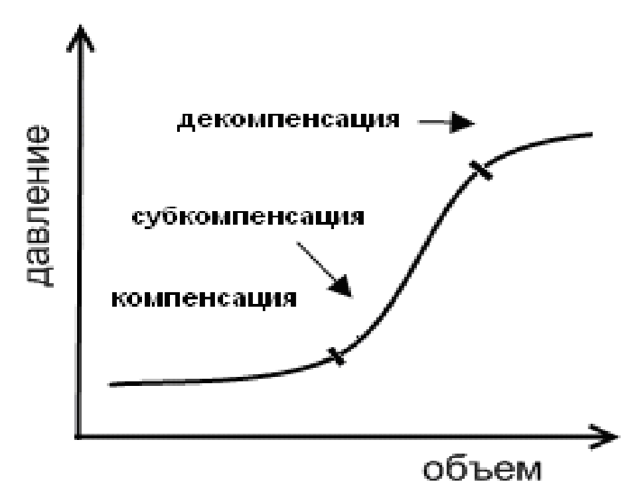
Взаимоотношения интракраниальных объемов в полости черепа можно представить графически кривой объем – давление (рис.2. Кривая взаимоотношения объем–давление: стадии компенсации, субкомпенсации и декомпенсации.). График представляет собой экспоненциальную кривую. В нем выделяют пологую часть, которая характеризует зону объемной компенсации. На данном участке графика любой прирост внутричерепного содержимого не приводит к повышению ВЧД, так как срабатывают ликворный и венозные механизмы компенсации. Однако возможности компенсаторных механизмов не безграничны и вслед за пологой частью следует более крутая часть экспоненты. На данном участке минимальный прирост внутричерепного объема (гематома, отек и др.) приводит к резкому повышению давление и развитию внутричерепной гипертензии. В клинической практике в этот момент мы регистрируем падение перфузионного давления, повышение ВЧД и появление плато-волн. Ели на данном этапе патологического процесса не будут приняты неотложные мероприятия, то наступает следующая фаза тяжелых нарушений с формированием ишемии, дислокации и вклинения головного мозга.
Важно помнить, что пациенты с церебральной патологией часто находятся именно в этой переходной зоне и имеют сниженный резерв объемной компенсации. Часто эти пациенты имеют угнетение уровня сознания (сопор, кома), находятся на продленной ИВЛ и получают седативную терапию. Всё это затрудняет адекватную клинико-неврологическую оценку в динамике. Развитие фазы декомпенсации у данной категории больных может произойти незаметно и достаточно быстро. При подобных клинических ситуациях мониторинг ВЧД позволяет своевременно диагностировать развитие внутричерепной гипертензии и оценить уровень компенсаторных механизмов.
Что такое ВЧД?
Единого определения ВЧД, как это не странно, но не существует. Согласно доктрине Монро-Келли это некое равномерно распределяемое давление внутри полости черепа.
Существуют и другие определения ВЧД, например:… это давление спинномозговой жидкости Cohadon F et al. 1974 [17]… давление в корковых венах и венозных синусах Johnston H. et al, 1974 [34]… давление ликвора в желудочках мозга Lundberg N. 1960 [38]Уравнение Davson описывает ВЧД как давление спинномозговой жидкости, которое зависит от скорости продукции ликвора, сопротивлением оттока ликвору и давления в сагиттальном венозном синусе [22, 23, 24]:ICP = CSF pressure = Resistance CSF outflow х Rate CSF outflow + P sagittal sinus,где ICP – внутричерепное давление, Resistance CSF outflow – сопротивление оттоку ликвора, Rate CSF outflow - скорость продкции ликвора, P sagittal sinus – венозное давление в сагиттальном синусе.
Однако только ликворное давление не может определять ВЧД. Согласно математической модели, которую описал Marmarou A. et al., кроме ликворного компонента важной составляющей при формировании ВЧД является «вазогенный» или сосудистый компонент [42]. По мнению автора, именно сосудистый («вазогенный») компонент играет решающую роль в формировании внутричерепной гипертензии у пациентов с травматическим отеком головного мозга. На ликворный компонент, по мнению автора, приходиться лишь третья часть в развитии внутричерепной гипертензии. Основными «вазогенными» механизмами, определяющими ВЧД, являются: артериальное давление, венозный отток, и ауторегуляция мозговых сосудов.
Общеизвестно, что как артериальная гипертензия [9], так и артериальная гипотензия [40, 70] могут приводить к внутричерепной гипертензии и отеку головного мозга за счет формирования гиперемии или ишемии. Затруднение венозного оттока приводит к увеличению кровенаполнения головного мозга и, в конечном счете, к развитию церебрального отека. Утрата ауторегуляции может вносить вклад в формирование отека головного мозга, как при развитии гиперемии, так и при ишемии [20, 30, 66, 77].
ВЧД в норме
Нормальные значения ВЧД могут варьировать в зависимости от возраста, положения тела, и клинического состояния. У взрослого человека в состоянии покоя на спине ВЧД колеблется от 5 до 15 мм рт.ст., а в положении стоя может принимать отрицательное значение до - 5, а при наличии шунтирующей системы недолжно быть ниже – 15 мм рт.ст. [16, 19]. В детском возрасте оно составляет величину от 3 до 7 мм рт.ст, а у новорожденных оно в пределах от 1,5 до 6 мм рт.ст.[25].
Значение ВЧД свыше 15-18 мм рт.ст. считается патологическим состоянием [20, 41]. Показанием для лечения при гидроцефалии является ВЧД выше 15 мм рт.ст., а при ЧМТ выше 20 мм рт.ст. [41, 71].
Методы регистрации ВЧД.
Методы измерения ВЧД условно можно разделить в зависимости от места расположения датчика ВЧД (рис. 3 Методы измерения ВЧД в зависимости от расположения датчика:
- субдуральное
- паренхиматозное
- вентрикулярное
- эпидуральное
- субарахноидальное
- твердая мозговая оболочка
- боковые желудочки мозга
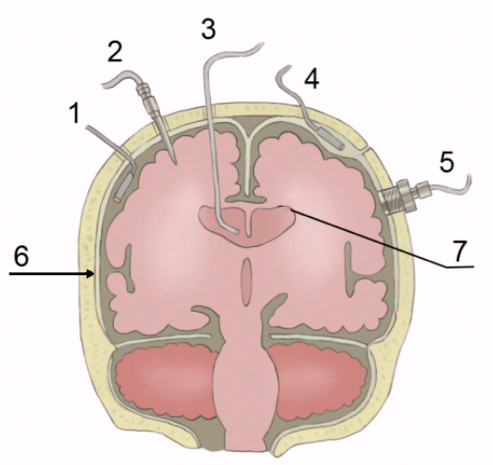
Наиболее ранним методом и сохраняющим за собой право называться «золотым» стандартом считается измерение ликворного давления в полости боковых желудочков мозга [38].
Вентрикулярное измерение ВЧД.
Для вентрикулярного измерения ВЧД в точке Kохера выполняется вентрикулостомия. Измерение ликворного желудочкового давления проводится при помощи тензометрического датчика, который располагается экстракраниально на уровне наружного слухового отверстия [31, 72]. Именно данное положение трансдьюссера обеспечивает нулевое значение ВЧД, что соответствует анатомической проекции отверстия Монро. Данная методика измерения ВЧД остается эталонной со времен работ Lundberg [29,38]. Метод не требует дорогостоящего оборудования, достаточно прост в использовании и интерпретации данных. Метод имеет свои преимущества и недостатки.
Преимущества вентрикулярного измерения ВЧД:Остается на протяжении многих лет самым дешевым и доступным.
Метод дает возможность проводить перекалибровку датчика при развитии «дрейфа нуля». Так же позволяет проводить анализ ликвора на клеточный и биохимический состав, выполнять метаболический и бактериологический мониторинг. Метод является не только диагностическим, но и терапевтическим, так как позволяет контролировать ВЧД путем дренирования ликвораК недостаткам метода можно отнести:Риск развития инфекционных (5%) и геморрагических осложнений (1,1%)Вероятность возникновения технические трудности при выполнении вентрикулостомии на фоне диффузного отека мозга и суженных боковых желудочков [20, 29, 31, 72].
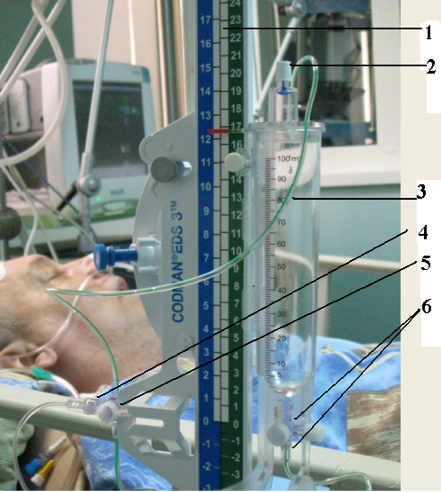
Соблюдение асептики и антисептики, антибактериальная профилактика, использование закрытых систем для вентрикулярного дренирования (рис. 4 Система наружного вентрикулярного дренирования Codman EDS 3 TM. 1 – измерительная линейка, 2 – воздушный фильтр накопительного резервуара, 3- резервуар, 4 – измерительный канал для подключения наружного тензометрического датчика, 5 - трех - ходовой кран для измерения ВЧД и дренирования ликвора, 6 – трех-ходовой кран для слива ликвора.), катетеров с антибактериальным покрытием позволяет снизить инфекционные осложнения [28, 76].
Другие инвазивные способы измерения ВЧД.
На сегодняшний день принято считать, что измерения ВЧД в субдуральном и субарахноидальном пространствах менее точно в сравнении с паренхиматозным и вентрикулярным измерением [29, 72]. Все попытки внедрения новых методик преследовали единственную цель - снизить вероятность инфекционных и геморрагических осложнений, а так же упростить способ установки датчика ВЧД. С этих позиций весьма обнадеживающим был метод эпидурального расположения датчика ВЧД. Однако показатели внутричерепного давления при эпидуральном измерении сильно завышались в сравнении с люмбальным и субдуральным измерением [54].
Были попытки измерения ВЧД в люмбальном пространстве, точнее измерение ликворного давления. Даная методика, как обсуждалось ранее, имела свои ограничения из-за неточности измерения при наличии компрессии ликворопроводящих путей. Нужно помнить, что люмбальная пункция при отеке мозга может вызвать аксиальную дислокацию и вклинение мозга. [37, 50]. В современных рекомендациях по детской нейротравматологии допускается дренирования люмбального пространства, как дополнительная опция при купировании неуправляемой внутричерепной гипертензии (ВЧГ). Метод рассматривается как способ, увеличивающий резерв краниоспинального пространства [7]. Есть опыт использования вспомогательного люмбального дренирования при некупируемой ВЧГ у пациентов с ЧМТ и САК. Авторы делают оговорку, что люмбальное дренирование можно использовать только при проходимости ликворопроводящих путей и отсутствии блока на уровне охватывающей цистерны [50]. Современные технологии позволяют проводить одновременно непрерывное измерение и контролируемое дренирование ликвора со строгим контролем заданного уровня ликворного давления, не допуская развития гипердренирования и дислокации головного мозга. Такими возможностями обладает система LiquoGuard (Moller medical GmbH @ CO.KG), позволяющая проводить контролируемое дренирование ликвора в пределах заданных значений ликворного давления.
Среди инвазивных методик наиболее распространенным остается паренхиматозный метод измерения. Датчик устанавливается в паренхиму мозгового вещества на глубину 2-2,5 см. Датчик устанавливается через трефинационное отверстие в точке Кохера, которая используются при пункции переднего рога бокового желудочка [31]. Датчик ВЧД может фиксироваться с помощью специальной болт-системы (Richmond bolt), либо с предварительным тунелированием под кожей. Датчик имплантируется в премоторную зону недоминантного полушария. Паренхиматозный метод измерения ВЧД считается предпочтительным, так как лучше остальных методов соответствует показаниям внутрижелудочкового измерения. Недостатком паренхиматозного измерения ВЧД является дороговизна датчика и невозможность перекалибровки, необходимость в которой возникает при «дрейфе нуля» [36, 63,71, 72].
Неинвазивные методы измерения ВЧД
В литературе освещены различные способы инвазивной и неинвазивной оценки ВЧД [1, 2, 5, 6, 7, .21, 29, 72]. Поиски более точного и легко воспроизводимого метода продолжаются. Актуальность разработки новых неинвазивных методик диктуется, прежде всего, попыткой свести к минимуму все осложнения, связанные с инвазивным измерением ВЧД. Кроме того, у отдельных пациентов и в отдельных возрастных группах, таких как новорожденные, младенцы, люди преклонного возраста, а так же у пациентов с нарушением гемостаза, использование неинвазивных методов измерения очевидно предпочтительнее [29, 51, 53].
В специальной литературе обсуждается возможность оценки ВЧД по смещению барабанной перепонки [62]. Предполагается, что изменение ВЧД меняет давление перилимфы в лабиринте улитки, а это приводит к смещению (деформации) барабанной перепонки. Однако эта методика описана только для пациентов с гидроцефалией. Обязательным условием применения этой методики является сохранность структур среднего уха и ствола мозга. По мнению авторов, результат измерения является суррогатным маркером ВЧД и может служить только как ориентировочный показатель, отражающий динамику изменения ВЧД у конкретного пациента. Метод требует дальнейшего совершенствования и не может пока быть рекомендован к широкому использованию.
Одной из попыток оценки ВЧД и ЦПД была интерпретация с помощью допплерографии. Для расчета ЦПД используется компьютерный анализ волновых характеристик артериального давления и линейной скорости кровотока. Метод позволяет проводить измерение ЦПД с погрешностью +/- 10 мм рт.ст [21].
Проводились исследования по измерению ВЧД с помощью офтальмодинамометрии. Метод зарекомендовал себя как неточный и давал большие погрешности у пациентов в коме и с миопией [49]. Не оправдал себя и метод количественной папилометрии, сущность которого заключается в оценки скорости папилоконстрикции, которая снижается при развитии внутричерепной гипертензии. Метод позволяет выявлять пациентов с выраженной гипертензией (ВЧД выше 20 мм рт.ст.), но требует использования специального оборудования [69].
В литературе освещены методы, основанные на оценке скорости прохождения ультразвуковой волны в полости черепа. Предполагается, что скорость прохождения ультразвуковой волны будет зависеть от плотности внутричерепного содержимого, т.е. меняться при развитии отека мозговой ткани. На пациентах с ЧМТ были получены сопоставимые результаты инвазивного («Camino») и неизнвазивного измерения ВЧД, полученного сонографическим монитором «Vittamed» [52].
У новорожденных и младенцев проводились измерения ВЧД неинвазивно через отверстие Фонтаннелле (незаращенный родничок) [43]. С этой целью был разработан специальный контактный датчик (Rotterdam Teletransducer), который прикладывался к незаращенному переднему родничку и фиксировался на голове при помощи облегченной рамы. Результаты мониторинга 70 младенцев, как здоровых, так и с различной неврологической патологией, дали весьма обнадеживающие результаты. Дальнейшее совершенствование данной технологии, показало сопоставимость показаний датчика Rotterdam Teletransducer на младенцах с гидроцефалией с инвазивным измерением ВЧД, а так же высокую степень корреляции двух методов (r=0,96-0,98) [51].
Разработка неинвазивных методов измерения ВЧД остается актуальной. В настоящее время, лидирующее место занимают различные ультразвуковые и телеметрические методы измерения. Вопрос о точности получаемых данных при неинвазивных методах остается открытым и требует дальнейшего уточнения. Все выше перечисленные методы не позволяют измерить абсолютное значение ВЧД, а только позволяют экстраполировать динамику его изменений.
Показания для измерения ВЧД.
За последние 15 лет использование ВЧД мониторинга не ограничивается только пострадавшими с ЧМТ. Перечень заболеваний, при которых проводиться измерение ВЧД значительно расширился [7, 27, 35, 50, 58, 64, 65]:- Внутричерепные кровоизлияния и САК - Гидроцефалия - Инсульт, сопровождающийся отеком головного мозга - Постгипоксическая энцефалопатия - Инфекционные менингиты - Печеночная энцефалопатия. Показания для проведения инвазивного измерения ВЧД четко установлены для пациентов с тяжелой черепно-мозговой травмой [71]. Прежде всего, показанием для мониторинга ВЧД является коматозное состояние и наличие патологических изменений по данным КТ. Показанием для проведения мониторинга ВЧД также является коматозное состояние при отсутствии изменений на КТ, но при наличии любых двух из трех признаков: возраст свыше 40 лет, позно-тонические реакции, систолическое АД < 90 mmHg.** Спорные вопросы мониторинга ВЧД.
Развитие внутричерепной гипертензии связывают с высоким риском летального исхода, однако есть сообщения, что не все пациенты с высоким ВЧД имеют неблагоприятный исход [56]. Это не удивительно, так как параметры ВЧД и ЦПД не могут характеризовать все патофизиологические процессы в поврежденном мозге и отражать всё многообразие церебральных процессов. В настоящее время показано, что терапия ориентированная только на параметры ВЧД и ЦПД в ряде клинических ситуаций не способна предотвратить развитие вторичного ишемического повреждения головного мозга [67]. На сегодняшний день не было проведено ни одного рандомизированного контролируемого исследования, подтвердившего влияние ВЧД мониторинга на исход травмы. Проводить данное сравнение не возможно по простым этическим соображениям. Кроме того, согласно расчетам, для подтверждения различий в исходах между сравниваемыми группами, потребуются значительные финансовые и материальные затраты [71, 72].
Опрос, проведенный среди нейрохирургов и интенсивистов разных стран, установил, что настоящее время не существует единого подхода к использованию различных методов мониторинга в нейроинтенсивной терапии. Что касается измерения ВЧД, то в США мониторинг ВЧД использовался у 83% пациентов с тяжелой ЧМТ [39], а в Великобритании и Ирландии было охвачено только 57% пострадавших [45]. Несмотря на то, что в Канаде был самый высокий показатель использования ВЧД, только 20 % нейрохирургов считают, что данный метод может существенно улучшить исход при ЧМТ [59].
Достаточно «интересное» исследование провела группа авторов из Голландии, которая сравнила исходы и агрессивность терапии среди пострадавших с тяжелой ЧМТ, поступивших в два разных медицинских центра. В первом центре не использовался ВЧД мониторинг, а среднее артериальное давление всем поступившим обеспечивалось на уровне не ниже 90 мм рт.ст. Во втором центре использовался протокол, ориентированный на обеспечение ЦПД выше 70 и ВЧД ниже 20 мм рт. ст. Вывод, сделанный авторами был весьма неожиданным. Терапия, ориентированная на протокол ВЧД/ЦПД приводит к увеличению длительности искусственной вентиляции легких и увеличивает агрессивность терапии, не улучшая исходы [18]. Работа часто цитируется на страницах специальной литературы, посвященной проблеме мониторинга ВЧД. Данная публикация противоречит большинству сообщений о ценности измерения ВЧД. Она часто используется как контраргумент в дискуссиях по данной проблематике, но одновременно является аргументом в пользу проведения проспективного исследования, которое смогло бы разрешить споры вокруг мониторинга ВЧД.
Градиенты давления в полости черепа.
Неравномерность распределения значений ВЧД в полости черепа в настоящее время является общепризнанным фактом, однако многие вопросы остаются нерешенными. Если бы полость черепа была заполнена однородной жидкостью, то давление во всех точках интракраниального пространства было бы одинаковым. Поскольку мозг является неоднородным по составу, его структуры (кора, проводящие пути, подкорковые ядра, сосудистая сеть и ликворные пространства) имеют разную плотность и упругость. Повышение давления в поврежденной зоне в каждом случае перераспределяется и выравнивается в полости черепа по-разному и в разные сроки. Очевидно, что упругость мозга зависит от количества внутри- и внеклеточной жидкости в ткани мозга, состояния сосудистой системы мозга и кровотока, наличия или отсутствия атрофии мозговой ткани и состояния ликворной системы. В настоящее время публикаций, посвященных исследованию интракраниальных градиентов давления и динамике перераспределения ВЧД, мало.
Существование градиента давления в полости черепа выше и ниже намета мозжечка было описано в послеоперационном периоде у пациентов перенесших операции по удалению опухолей в задней черепной ямке [58, 64]. Rossenwasser и соавт. установили, что в ВЧД в задней черепной ямке превышало значение ВЧД в просвете желудочков мозга в среднем на 50%. Данный градиент сохранялся в послеоперационном периоде до 12 часов [58].
При одновременной двусторонней регистрации внутричерепного давления в субдуральном пространстве у пациентов с супра- и инфратенториальными опухолями всегда выявлялся градиент давлений между здоровой и пораженной стороной [13].
При острых субдуральных гематом одновременное измерение ВЧД в паренхиме обеих лобных долей выявило межполушарный градиент давления, который превышал 10 мм рт.ст. Однако при очаговых поражениях вещества мозга и при внутримозговых гематомах градиент ВЧД не регистрировался. По мнению авторов, проводивших данное сравнительное исследование, измерение ВЧД при субдуральных гематомах целесообразно проводить со стороны поражения (ипсилатерально) [15].
В клинических работах Yano M. и соавт. не был выявлен межполушарный градиент при различных видах травматического поражения [75]. По сообщению других авторов при различных интракраниальных поражениях (оболочечные гематомы, очаги ушиба, и т.д.) супратенториальный градиент давления мог быть весьма значительным, достигая 20-28 мм рт. ст.[11, 12, 44, 74]. Mindermann and Gratz (1998) на группе пациентов с ЧМТ показали, что даже при отсутствии повреждений с масс-эффектом, может развиваться межполушарный градиент давлений. Авторы утверждают, что одновременное 2-х стороннее измерение ВЧД может быть оправдано в раннем периоде ЧМТ, а контроль ЦПД с коррекцией внутричерепной гипертензии могут устранять данный градиент [48].
При сравнении групп с различным видом повреждения головного мозга, было установлено, что межполушарный градиент давления отсутствует при диффузном повреждении и появляется при очаговом повреждении. При очаговом повреждении градиент давления разрешался в течение 4 часов и указывал на трансформацию первичного очага либо формирование нового очага. Важным условием для разрешения градиента давления, по мнению авторов, была проходимость субарахноидальных пространств. Частота развития градиента давления при очаговом супратенториальном повреждении мозга составила 25%. У большинства из этих пациентов на КТ регистрировалось латеральное смешение срединных структур [60].
Наиболее важными из патофизиологических механизмов, приводящих к формированию градиента давлений, принято считать формирование вазогенного отека в зоне вокруг опухоли или очагового повреждения мозга [57]. На фоне формирования и трансформации первичных очагов поражения мозговой ткани так же происходят изменения локального мозгового кровотока, содержания жидкости в веществе мозга, изменение упругости мозга – все эти динамические патофизиологические процессы так же приводят к развитию градиента давлений в веществе мозга [47, 61, 68]. Определенный вклад в развитие градиента давлений при отеке головного мозга вносит нарушение венозного оттока, которое развивается при обструкции венозных коллекторов на фоне повышенного ВЧД [26].
При паренхиматозном измерении ВЧД сторона расположения датчика зависит от характера поражения мозговой ткани. При очаговом поражении мозга датчик располагается со стороны патологического очага (гематома, ушиб и т.д.), при диффузном повреждении (ДАП, диффузный отек и др.) - измерение проводиться со стороны не доминантного полушария. Одновременное измерения ВЧД в разных зонах (билатеральное, инфра- и супратенториальное, вентрикулярное и люмбальное) при разной патологии всегда демонстрировало наличие градиента давлений. Ряд авторов полагают, что только у небольшой группы пациентов мультифокальное измерение ВЧД может быть оправдано [48, 60].
Важность своевременной диагностики градиента давлений обусловлена тем, что развитие градиента может приводить к дислокации структур мозга. Ригидность конструкции черепа, неравномерность его основания с многочисленными костными выступами, а так же наличие выростов твердой мозговой оболочки (фалькс, намет мозжечка и др.) при дислокации мозга обуславливают разные виды вклинения [4].
Приведенный обзор свидетельствует о неравномерности распределения давления в полости черепа. Важным остается вопрос о выборе метода измерения и месте расположения датчика ВЧД. Современные рекомендации по мониторингу предполагают измерение только «глобального» ВЧД, с преимущественным использованием вентрикулярного и паренхиматозного методов измерения [7, 71, 72]. В нейрохирургии и нейроинтенсивной терапии принятие решения по тактике ведения всегда проводиться на основании комплексной оценки больного, которая включает мониторинг «глобального» ВЧД, методы нейровизуализации (КТ, МРТ), а так же клинико-неврологическую оценку.
Аргументы в пользу мониторинга ВЧД или почему важно измерять ВЧД.
Внутричерепная гипертензия встречается у 80% пострадавших с тяжелой ЧМТ, причем у трети развивается неуправляемая ВЧГ и в последствии они погибают [10, 40, 43, 46]. В группе пациентов c тяжелой ЧМТ нормальным ВЧД летальность составляет 17%, а при повышении ВЧД свыше 20 мм рт.ст. достигает 47% [10].
Внутричерепная гипертензия является фактором неблагоприятного исхода при травматическом повреждении головного мозга. Прогностическое значение имеет не только выраженность, но и длительность гипертензии. Чем дольше по времени существует внутричерепная гипертензия, тем выше вероятность неблагоприятного исхода и выхода в вегетативное состояние [40]. Установлено, что не только длительность внутричерепной гипертензии, но и ответ на терапию имеет прогностическое значение [73].
В настоящее время измерение ВЧД уже вошло в разряд рутинных клинических методик. Измерение ВЧД проводиться у разной категории пациентов, как у пациентов с САК и ЧМТ, так и пациентов после удаления новообразований головного мозга. Мониторинг ВЧД позволяет контролировать и управлять церебральным перфузионным давлением (ЦПД) у пациентов с осложненным течением послеоперационного периода, а так же проводить направленную патогенетическую терапию при различной церебральной патологии: отеке мозга, церебральной дисгемии и др. [7, 19, 29, 38, 39, 70, 72].
Мониторинг ВЧД позволяет оценить эффективность проводимой противоотечной терапии. Нельзя проводить терапию, не оценив эффективность и продолжительность её эффекта [9, 29, 30]. Инвазивное измерение ВЧД дает возможность измерять церебральное перфузионное давление, которое отражает эффективность мозгового кровотока и является независимым прогностическим показателем [70]. При мониторинге ВЧД специальное программное обеспечение позволяет оценить состояние церебральной ауторегуляции и упругости мозга [19, 27]. Данная информация имеет ценное значение при выборе тактики терапии. Так на основании расчетного коэффициента церебральной реактивности мозговых сосудов можно добиться «оптимальных значений» ЦПД [3, 20, 66, 77].
Заключение
Не смотря на полувековую историю измерения ВЧД, продолжаются поиски и разработки новых методов измерения ВЧД. При лечении пациентов с острой церебральной патологией одной из важных задач остается лечение внутричерепной гипертензии. Мониторинг внутричерепного давления обеспечивает быструю и точную диагностику данного патологического состояния и позволяет проводить направленную патогенетическую терапию, что благоприятно сказывается на исходах лечения.
Литература
- Башкиров М.В., Шахнович А.Р., Лубнин А.Ю. Внутричерепное давление и внутричерепная гипертензия. Российский журнал анестезиологии и интенсивной терапии 1999; 1: 4-11.
- Белкин А.А., Алашеев А.М., Инюшкин С.Н. Транскраниальная допплерография в интенсивной терапии. Методическое пособие для врачей. Екатеринбург: Издание Клинического института Мозга СУНЦ РАМН; 2004.
- Ошоров А.В., Савин И.А., Горячев А.С. и соавт. Первый опыт применения мониторинга ауторегуляции мозговых сосудов в остром периоде тяжелой черепно-мозговой травмы. Анестезиология и реаниматология 2008; 2: 16 – 20.
- Плам Ф., Познер Д. Диагностика ступора и комы. Пер. с англ. М.: Медицина; 1986.
- Сарибекян А.С. Транскраниальная допплерография при оценке уровня внутричерепного давления. Журн. неврол. и психиатр 1994; 1: 34-37.
- Шахнович А.Р., Шахнович В.А. Диагностика нарушений мозгового кровообращения (транскраниальная допплерография). М. Медецина; 1996.
- Adelson PD., Bratton SL, Carney NA. et al. Guidelines for the acute medical management of severe traumatic brain injury in infants, children, and adolescents. Pediatr. Crit. Care Med. 2003; (4) 3.
- Andrews P, Citerio G. Intracranial pressure. Part one: Historical overview and basic concept. Intensive Care Med. 2004; 30: 1730-1733.
- Asgeirsson B., Grande PO., Nordstrom CH. A new therapy of post-trauma brain oedema based on haemodynamic principles for brain volume regulation. Intensive Care Med. 1994; 20: 260 – 267.
- Balestreri M., Czosnyka M., Hutchinson P., et al. Impact of intracranial pressure and cerebral perfusion pressure on severe disability and mortality after head injury. Neurocrit. Care 2006; 4: 8 – 13.
- Banister K, Chambers IR, Siddique MS, et al. Intracranial pressure and clinical status: assessment of two intracranial pressure transducers. Physiol. Meas. 2000; 21(4): 473-479.
- Broaddus WC, Pendleton GA, Delashaw SB, et al. Differential intracranial pressure recording in patient with dual ipsilateral monitors. In: Hoff JH, Betz AL. (eds) Intracranial pressure VII. Berlin, Springer, 1989. 41-44.
- Bundgaard H., Cold GE. Studies of regional subdural pressure gradients during craniotomy. Br. J. Neurosurg. 2000; 14(3): 229 – 234.
- Castellani G, Zweifel C, Kim DJ, Carrera E, et al. Plateau waves in head injured patients requiring neurocritical care. Neurocrit. Care 2009; 11(2): 143-50.
- Chambers IR, Kane PJ. Signorini DF, et al. Bilateral ICP monitoring: its importance in detecting the severity of secondary insults. Acta Neurochir. Suppl. 1998; 71: 42-43.
- Chapman PH., Cosman ER., Arnold MA. The relationship between ventricular fluid pressure and body position in normal subjects and subjects with shunts: a telemetric study. Neurosurgery 1990; 26: 181–189.
- Cohadon F. et al. Physiology of intracranial pressure. General physiopathology of intracranial hypertensions. Neurochirirgie 1974; 20(6): 489 – 520.
- Cremer OL., van Dijk GW., van Wensen E. Effect of intracranial pressure monitoring and targeted intensive care on functional outcome after severe head injury. Crit. Care Med. 2005; 33: 2207 – 2213.
- Czosnyka M. and Pickard JD. Monitoring and interpretation of intracranial pressure. J. Neurol. Neurosurg. Psychiatry 2004; 75: 813 – 821.
- Czosnyka M, Brady K, Reinhard M, et al. Monitoring of cerebrovascular autoregulation: facts, myths, and missing links. Neurocrit. Care. 2009; 10 (3): 373-86.
- Czosnyka M, Matta B, Smielewski P. Cerebral perfusion pressure in head-injured patients: a noninvasive assessment using transcranial Doppler ultrasonography. J. Neurosurg. 1998; 88: 802 – 808.
- Davson H, Hollingsworth G, Segal MB. The mechanism of drainage of the cerebrospinal fluid. Brain 1970; 93: 665 – 678.
- Davson H. Physiology of the cerbrospinal fluid. Edinburg: Churchill; 1967.
- Davson NH, Welch K, Segal MB. The physiology and pathophysiology of cerebrospinal fluid. New York: Churchill Livingstone; 1987.
- Dunn LT. Raised intracranial pressure. J Neurol. Neurosurg. Psychiatry 2002; 73(1): 23–27.
- Ecker H. Irregular fluctuation on elevated cerebrospinal fluid pressure. Such fluctuations as a measure of dysfunction of cerebrovascular episodes, pseudotumor cerebri and head injury. Arch. Neurol. Psychiatry 1955; 74: 641-649.
- Eide P.K. A new method for processing of continuous intracranial pressure signals. Med Eng Physics 2006; 28: 579–587.
- Fichtner J, Güresir E, Seifert V, Raabe A. Efficacy of silver-bearing external ventricular drainage catheters: a retrospective analysis. J Neurosurg. 2009.
- Ghajar J. Intracranial pressure monitoring techniques. New Horiz. 1995; 3(3): 395-339.
- Grande PO, Asgeirsson B, Nordstrom C. Aspects on the cerebral perfusion pressure during therapy of a traumatic head injury. Acta Anaesthesiol. 1997; 110: 36 – 40.
- Greenberg MS. Handbook of neurosurgery. Fifth edition. New York: Thieme; 2001.
- Guillaume J, Janny P. Manometrie intracranienne continué interest de la methode et premiers resultants. Rev. Neurol. 1951; 84: 131 – 142.
- Janny P. La pression intra-cranielle chez l`home. These (1950). Aubiere: Clermont-Reproduction 1972.Continuous recording and control of ventricular fluid pressure in neurosurgical practice. Acta psychiat. Kbh. 1960; 149: 193.
- Jonston H.I., Rowan J.O: Raised intracranial pressure and cerebral blood flow.3.Venous outflow tract pressure and vascular resistances in experimental intracranial hypertension. J.Neurol. Neurosurg. Psychiatry 1974; 37: 392-402.
- Keays RT, Alexander GJ, Williams R. The safety and value of extradural intracranial pressure monitors in fulminant hepatic failure. J. Hepatol. 1993; 18: 205-209.
- Koshkinen LO, Olivecrona M. Clinical experience with the intraparenchymal intracranial pressure monitoring Codman MicroSensor system. Neurosurgery 2005; 56: 693 – 698.
- Langfitt TW, Weinstein JD, Kassell NF, et al. Transmission of increased intracranial pressure I. Within the Craniospinal Axis. J. Neurosurg 1964; 21(11): 989 – 997.
- Lundberg N. Continuous recording and control of ventricular fluid pressure in neurosurgical practice. Acta psychiat. Kbh. 1960; 149: 193.
- Marion D.W., Spiegel T.P. Changes in






