Трахеостомия является одним из способов обеспечения проходимости дыхательных путей для проведения длительной респираторной поддержки.
В настоящее время общепризнанными показаниями к выполнению трахеостомии у больных с черепно-мозговой травмой (ЧМТ) являются:
- 1) переломы основания черепа, с ликвореей;
- 2) кранио-фациальная травма;
- 3) выраженные бульбарные нарушения;
- 4) длительные коматозные состояния;
- 5) сочетание ЧМТ с инфекционными бронхолегочными осложнениями.
Особое место занимают больные с повреждением лицевого скелета и основания черепа [8]. В связи с угрозой развития менингита, энцефалита при проникающей ЧМТ длительная интубация трахеи нежелательна.
У этой категории больных трахеостомия выполняется в течение 48—72 ч после поступления.
Противопоказанием для проведения трахеостомии в остром периоде ЧМТ является внутричерепная гипертензия, так как операция может провоцировать критическое снижение церебрального перфузионного давления.
Транскутанная дилатационная трахеостомия (ТДТ) [2, 7, 9, 10], обладающая целым рядом преимуществ по сравнению со стандартной трахеостомией, расширила возможность выполнения операции у больных в остром периоде ЧМТ [16].При анализе литературы было показано, что данных о динамике внутричерепного давления (ВЧД) во время ТДТ у больных с ЧМТ нет, а также отсутствуют рекомендации по предотвращению внутричерепной гипертензии (ВЧГ) при выполнении операции. В данной работе представлен опыт выполнения ТДТ у больных в остром периоде тяжелой ЧМТ в условиях мониторинга ВЧД во время операции. Предложенная методика позволила избежать критических подъемов ВЧД и снижения церебрального перфузионного давления.
Цели и задачи работы определить динамику ВЧД у больных с ЧМТ в ходе операции ТДТ. Выявить этапы операции с нарастанием ВЧД и разработать эффективные способы предотвращения внутричерепной гипертензии в ходе операции ТДТ.Материал и методы.В исследование включены 24 больных, поступивших в отделение реанимации НИИ нейрохирургии им Н. Н. Бурденко с июня 2002 г. по декабрь 2005 г. Все больные госпитализированы с диагнозом тяжелой проникающей краниофациальной ЧМТ. На момент поступления средний балл по шкале комы Глазго (ШКГ) составлял 6 + 2.
Распределение по полу представлено следующим образом: 17 мужчин, 7 женщин. Средний возраст пострадавших составил 36 ± 7 лет.Критериями включения в исследование являлись острый период ЧМТ (до 72 ч), ШКГ менее 8 баллов, мониторинг ВЧД. показания для выполнения трахеостомии.
При поступлении всем больным была выполнена компьютерная томография (КТ) головного мозга. Общим для всех больных являлись признаки выраженного отека головного мозга с компрессией базальных цистерн и желудочковой системы. У 15 больных поданным КТ-исследования выявлен перелом основания черепа, у 11 больных — гемосинусит.
У всех больных определялась ликвореи: у 13 больных ликворея из наружных слуховых проходов, у 12 назальная. Показаниями к трахеостомии служили массивные повреждения лицевого скелета и ликворея, что является фактором риска развития вторичных инфекционных осложнений ЦНС.
Мониторинг и структура интенсивной терапии больных проводились по стандартному международному протоколу ведения больных с ТЧМТ [13]. Мониторинг осуществлялся по стандартной методике HP (Hewlett-Packard M1092AA): ВЧД, инвазивное измерение АД, ЦПД, SpO2, EtCO2, ЧСС. Для мониторинга ВЧД использовались датчики IСР ("Codman microsensor kit"), установленные субдурально или паренхиматозно. Датчики устанавливались хирургами после КТ-исследования и получения данных о признаках ВЧГ.
Все больные были интубированы оротрахеально. ИВЛ осуществлялась респираторами Puritan-Benett 7200 в режимах с управляемой минутной вентиляцией — CMV либо SIMV. Операции выполняли в условиях тотальной внутривенной анестезии. Для вводного наркоза использовали гипнотики (бензодиазепины/пропофол), миорелаксанты (с целью выключения кашлевого рефлекса), наркотические анальгетики (фентанил, промедол) и холинолитические препараты. Для под держания анестезии использовали наркотические анальгетики (фентанил) и пропофол. Дозировки и комбинации препаратов зависели от конституциональных показателей больного и клинической ситуации.
Выполнение операции проводилось по комбинированной методике Сигли и Григса с использованием коммерческих наборов фирм "Portex и COOK" [1]. В случае необходимости операционная бригада была готова к выполнению операции хирургическим методом.
Таблица 1 Диаметр использованных интубационных трубок и сроки трехео-стомии
| N° трубки | Число больных | Доля в группе |
| 7 | 4 | 0.16 |
| 7,5 | 5 | 0,21 |
| 8 | 8 | 0,33 |
| 8,5 | 4 | 0,16 |
| 9 | 3 | 0,13 |
| Сроки трахеостомии,сутшии, сутки | Число больных | Доля в группе |
| 1-e | 5 | 0,21 |
| 2-e | 12 | 0,5 |
| 3-й | 7 | 0,29 |
Методика трахеостомии
Положение больного: приподнятый на 30° головной конец, без переразгибания шеи. После подтверждения стабильного состояния больного, отсутствия колебаний ВЧД, АД, EtCO2, SpO2; на фоне ИВЛ с использованием специального коннектора производится фиброскопия (с видеоконтролем) [12].
После вводного наркоза интубационная трубка под контролем бронхоскопа подтягивается кверху до визуализации светового пятна в проекции яремной вырезки и фиксируется. В асептических условиях пунктируется трахея иглой в проекции 3 - 4-го межкольцевого промежутка. После визуализации положения иглы в просвете трахеи через иглу в трахею вводится металлический проводник. В месте пункции проводится инфильтрация тканей раствором новокаина. Выполняется поперечный разрез кожи (1,5 — 2 см). Формирование трахеостомической раны производится зажимом Ховарда—Келли и/или бужем BlueRhino (COOK). В сформированную трахеостому по проводнику устанавливается трахеостомическая трубка. После подтверждения положения трахеостомической трубки в просвете трахеи трубка фиксируется. ИВЛ продолжается через трахеостомическую трубку. Удаление интубационной трубки производится под бронхоскопическим контролем. По окончании операции проводится санационная бронхоскопия.
Средняя продолжительность операции с момента вводного наркоза до удаления интубационной трубки составила 20 ± 6 мин. Продолжительность наиболее агрессивных этапов операции (выдвижение интубационной трубки, формирование стомы и установка трахеостомической трубки) составила в среднем 4 ± 2 мин. В ходе операций не было ни одного осложнения.
Сроки трахеостомии: всем больным операция выполнена до 72 ч с момента травмы. 5 больным в течение 24 ч, 12 больным — 48 ч и 7 больным операция произведена на 3-й сутки после травмы (табл. 1).
Все больные были интубированы оротрахеально. Диаметр интубационных трубок от 7 до 9 мм (табл. 1).
Фибробронхоскопия: эндоскопический контроль осуществляли фибробронхоскопами Karl Storz (Karl Storz 11001 BN1 и Karl Storz 11002 BD1) с выведением изображения на монитор через видеоадаптер Karl Storz.
Количество бронхоскопий, потребовавшихся в ходе одной операции, составило от 3 до 6. Длительность одного этапа бронхоскопии составила от 20 до 60 с, а суммарно за одну операцию от 60 до 160 с, что составляло 30—50% длительности наиболее агрессивных этапов.
Результаты исследований и их обсуждение
После установки датчика у всех больных получены данные, свидетельствующие о ВЧГ, и потребовавшие проведения активной противоотечной терапии.
К моменту начала операции у всех больных на фоне проводимой интенсивной терапии внутричерепной гипертензии и при положении больного с приподнятым головным концом была достигнута стабилизация показателя на уровне 15 + 5 мм рт. ст.
При выполнении операции валик под плечи не укладывался для предупреждения нарушений венозного оттока и нарастания ВЧГ.
При проведении пробы с горизонтальным положением больного отмечена тенденция к повышению ВЧД более 20 мм рт. ст. У 5 больных при попытке опускания головного конца быстрое нарастание ВЧД более 40 мм рт. ст. потребовало немедленного возвращения в исходное положение. У 19 больных повышение ВЧД происходило в течение 1—2 мин после опускания головного конца и к 2-й минуте превышало 25 мм рт. ст. Учитывая повышение показателя ВЧД при опускании головного конца, все операции выполнялись в положении пациента с приподнятым на 30° головным концом без укладывания валика под плечи.
В ходе операции у всех больных отмечалось изменение показателей ВЧД. По выраженности и длительности эпизодов повышения давления можно выделить 2 группы (табл. 2): 1-я — больные, у которых колебания ВЧД не превышали 25 мм рт. ст. или повышение ВЧД носило кратковременный характер до 2 мин (15 наблюдений); 2-я — больные с колебаниями ВЧД более 25 мм рт. ст. по продолжительности, не превышавших 5 мин (9 наблюдений).
У всех больных через 5 мин после установки трахеостомической трубки отмечена стабилизация ВЧД и возвращение к исходным показателям. При дальнейшем наблюдении колебания ВЧД соответствовали течению основного заболевания. Все больные, включенные в исследование, были переведены из отделения реанимации в нейрохирургические отделения для дальнейшего лечения. Летальных исходов не было. В настоящее время в мировой практике не выработано единого мнения о сроках выполнения трахеостомии у больных с ЧМТ. Выполнение трахеостомии в ранний период ЧМТ с наличием ВЧГ связано с высоким риском нарастания ВЧД и ухудшением прогноза заболевания. Однако ряд авторов [5, 6] утверждают, что ранняя трахеостомия снижает риск гнойно-воспалительных осложнений ЦНС и улучшает исходы. К данной категории относятся больные с тяжелой ЧМТ, сопровождающейся переломами основания черепа, ликвореей.
Таблица 2
| Показатель | 1-я группа | 2-я группа |
| ВЧД | Повышение до 25 мм рт. ст. | Повышение более 25 мм рт. ст. |
| EtCO2 | < 35% | >40 – 50% |
| PIP | До 35 см вод. ст. | До 50 см вод. ст. |
| № трубки | 8 мм (№ 8) | <8 мм (№ 8) |
| количество больных | 10 + 5 | 9 |
- 5 пациентов вошли в группу после модификации методикис учетом рекомендаций, указанных в обсуждении.
Динамика показателей ВЧД и EtCO2, у больных 1-й и 2-й групп.
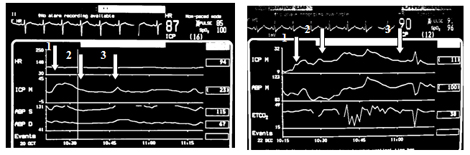
а — пример трендов ВЧД у больного 1-й группы, б — пример тренлов ВЧД у больного 2-й группы.
1 — проба горизонтализации. 2 — начало операции, 3 — окончание операции, санационная бронхоскопияКроме того, трахеостомия в ряде случаев является необходимым этапом реконструктивных операций на лицевом скелете.
Преимуществами ранней трахеостомии являются [1]:
- повышение качества санации с одновременным сокращением времени санации, более простая замена трахеостомической трубки, снижение риска асфиксии вследствие окклюзии интубационной трубки мокротой, практически минимален риск однолегочной вентиляции;
- снижение риска развития синуситов, отитов (по данным литературы, у 70% больных, интубированных назотрахеально в течение 48 ч, развиваются вышеуказанные осложнения), аспирационных пневмоний на фоне повышения достоверности микробиологических тестов;-облегчение проведения бронхоскопий и ингаляций;
- трахеостомическая трубка субъективно легче переносится пациентом (отсутствует инородное тело в носоротоглотке), вызывая меньше болевых ощущений, позволяя не седатировать больного, вентилируя его во вспомогательных режимах вентиляции. Тем самым облегчается синхронизация (адаптация) больного с респиратором, снижается риск ателектазов и пневмотораксов;
- при трахеостомической трубке возможна оценка состояния ротоглотки и гортани. Это принципиально важно для профилактики контаминации ротоглотки, соответственно для снижения риска аспирационных пневмоний. Также появляется возможность адекватно, своевременно оценивать регресс бульбарных нарушений (подвижность надгортанника и голосовых складок), в том числе с помощью фиброскопа;
- наличие трахеостомы при удовлетворительной функции дыхания даже при грубых бульбарных нарушениях позволяет отучить больного от ИВЛ при использовании трахеостомической трубки с герметизирующей манжетой.
Основными сложностями при выполнении трахеостомии у больных с ЧМТ является необходимость укладки больного с переразгибанием шеи, что нарушает венозный отток, провоцирует повышение ВЧД и противоречит принципам лечения ЧМТ [13]. Также нами было получено у всех больных значительное повышение ВЧД при опускании головного конца кровати (проба горизонтализации). Была разработана методика выполнения ТДТ с приподнятым головным концом без выведения трахеи (валика под плечами).
В ходе проведения нашего исследования были выделены 2 группы больных: 1-я, в которой значения ВЧД не превышали 25 мм рт. ст., 2-я, в которой значения ВЧД были более 25 мм рт. ст.
В 1-й группе у 7 пациентов отмечались подъемы ВЧД более 25 мм рт. ст., однако нормализации ВЧД удавалось достигнуть прекращением активных действий. Таким образом, подъемы ВЧД носили кратковременный характер (не более 2 мин).
Во 2-й группе повышение ВЧД отмечались у всех пациентов. При анализе было отмечено, что внутренний диаметр интубационных трубок у больных этой группы был менее 8 мм (см. рисунок).
При анализе трендов EtCO2 было показано, что повышения ВЧД происходили на фоне гиповентиляции при проведении бронхоскопии в обеих группах, но были различны по выраженности. Причиной повышения EtCO2 до 40—45 являлась гиповентиляция, возникающая в ходе бронхоскопии из-за повышения сопротивления потоку воздуха. При расчете дополнительного сопротивления, возникающего при нахождении бронхоскопа в просвете интубационной трубки, было показано, что сопротивление возрастает в 2—7 раз, так как сопротивление обратно пропорционально 4-й степени радиуса трубки.
В ходе анализа значений дополнительного сопротивления и ∆EtCO2 было показано, что при соотношении диаметра бронхоскопа к диаметру интубаиионной трубки более 0,5 сопротивление резко возрастает до 7 раз. Чтобы избежать гиповентиляции в ходе проведения бронхоскопии предлагается: 1) использование интубационных трубок (по возможности) диаметром 8 мм и более, 2) использование бронхоскопа с минимальным наружным диаметром (менее 50% от диаметра трубки), 3) укорочение трубки после выдвижения, 4) минимизация времени бронхоскопии до постановки трахеостомической канюли, 5) умеренная гипервентиляция на начало проведения вмешательства, 6) преоксигенация.
Нами предлагается использование бронхоскопии на следующих этапах операции: 1-й — выдвижение трубки, 2-й — пункция трахеи, 3-й — санация через трахеостомическую канюлю.
При повышении ВЧД в ходе бронхоскопии более 20 мм рт. ст. рекомендуется удалить бронхоскоп из интубационной трубки с целью нормализации вентиляции и ВЧД.
После проведения предварительно анализа результатов мы модифицировали методику проведения трахеостомии с учетом вышеизложенных рекомендаций. У 5 пациентов мы не получили выраженных колебаний ВЧД, а также подъемов выше 20 мм рт. ст., что позволяет рекомендовать данную методику для выполнения трахеостомии у больных с ТЧМТ в остром периоде (до 72 ч).
Заключение
Таким образом, при выполнении ТДТ у больных в остром периоде краниофациальной ТЧМТ выделены 2 группы мер по профилактике ВЧГ: положение без валика под плечами и приподнятый головной конец; меры по профилактике нарушений вентиляции в ходе бронхоскопического контроля.
Литература
- Горячев А- С, Савин И. А., Горшков К. М. и др. // Анестезиол. и реаниматол. — 2004. — № 2. — С. 58—61.
- Эпштейн С. Л., Романовский Ю. Я. // Вестн. Интенсив. тер. — 1997. — № 4. — С. 33—34.
- Anderson H. L, Bartlett R. Н. // Clin. Chest Med. — 1991. -Vol. 12. - P. 555-560.
- Barda С. A., Angood P. В., Kauder D. R. el al. // Surgery. —1995.- Vol. 118. - P. 879-883.
- Bouderka M. A., Fakhir В., Bouaggad A. et al. // J. Trauma. —2004. - Vol. 57, N 2. - P. 251-254.
- Chintamani, Khanna J., Singh J. P. et al. // BMC Emerg. Med.-2005. - Oct 14; 5:8.
- Ciaglia P., Firsching R. N. // Chest. - 1985.
- Davies M. A., Teo C. // J. Craniomaxillofac. Trauma. — 1995.-Vol. 1, N 2. - P. 9-17.
- Fernandez C, Norwood S., Roeltger R. et al. // Arch. Surg. —1996.- Vol. 131. - P. 129-132.
- Griggs W. M. // Surg. Gynnecol. Obstetr. — 1990. — Vol. 170.-P. 543-545.
- Hutchinnson R. C, Mitchel R. D. // Crit. Care Med. - 1991.-Vol. 19- - P. 1018-1024.
- Ivalury R., Siegel J. #., Staht W. M. et al. // J. Trauma. -1992. - Vol. 32. -P. 133-140.
- Management and Prognosis of Severe Traumatic Brain Injury.Part I. Guidelines for Management of Severe Traumatic Brain Injury. A Joint Project of the Brain Trauma Foundation American Association of Neurological Surgeons, Joint Section on Neurotrauma and Critical Care С 2000, Brain Trauma Foundation ISBN 0-9703 144-0-X.
- Mathison J. // Chest. - 1990. - Vol. 98. - P. 1049-1050.
- Mayberry J. C, Wu I. C. Goldman R. K., Chesnut R. M. //Crit. Care Med. - Vol. 28, N 10. - P. 3436-3440.
- Moore F. A., Haenel J. В., Moore E. E., Read R. A. // J. Trauma. - 1993. - Vol. 34, N 6. - P. 916-917.
- Reilly P. M., Anderson ff. L, Sing R. F. et al. // Chest. -1995. - Vol. 107. - P. 1760-1763.
- Reilly P. M., Sing R. F., Giberson F. A- et al. // Intensive Care Med. - 1997. - Vol. 23, N 8. - P. 859-864.
- Wall M. K., Eigler F.-W. // Chirurg. - 1996. - Bd 67. -S. 436-446.






